Dãy năng lượng điện hóa của kim loại là phần lý thuyết đặc biệt quan trọng xuất hiện nhiều trong số đề thi học kỳ, đh và học viên giỏi. Nội dung bài viết ngày hôm nay VIETCHEM sẽ chia sẻ bài giảng hàng điện hóa của kim loại đầy đủ, dễ thuộc, dễ nhớ để ứng dụng vào làm bài xích thi đúng chuẩn nhất.
Bạn đang xem: Dãy điện hóa đầy đủ nhất
1. Hàng điện hóa của kim loại là gì?

Dãy năng lượng điện hóa là gì? lý thuyết bài tập vận dụng
Nắm vững những lý thuyết dãy điện hóa kim loại sẽ giúp chúng ta học sinh kết thúc tốt những bài tập hóa vô cơ. Trong hóa học, cation kim loại rất có thể nhận electron để vươn lên là nguyên tử kim loại, ngược lại, những nguyên tử kim loại rất có thể nhường electron để sinh sản thành các cation kim loại, lấy ví dụ như như:
Cu2+ + 2e ↔ Cu
Ag+ + 1e ↔ Ag
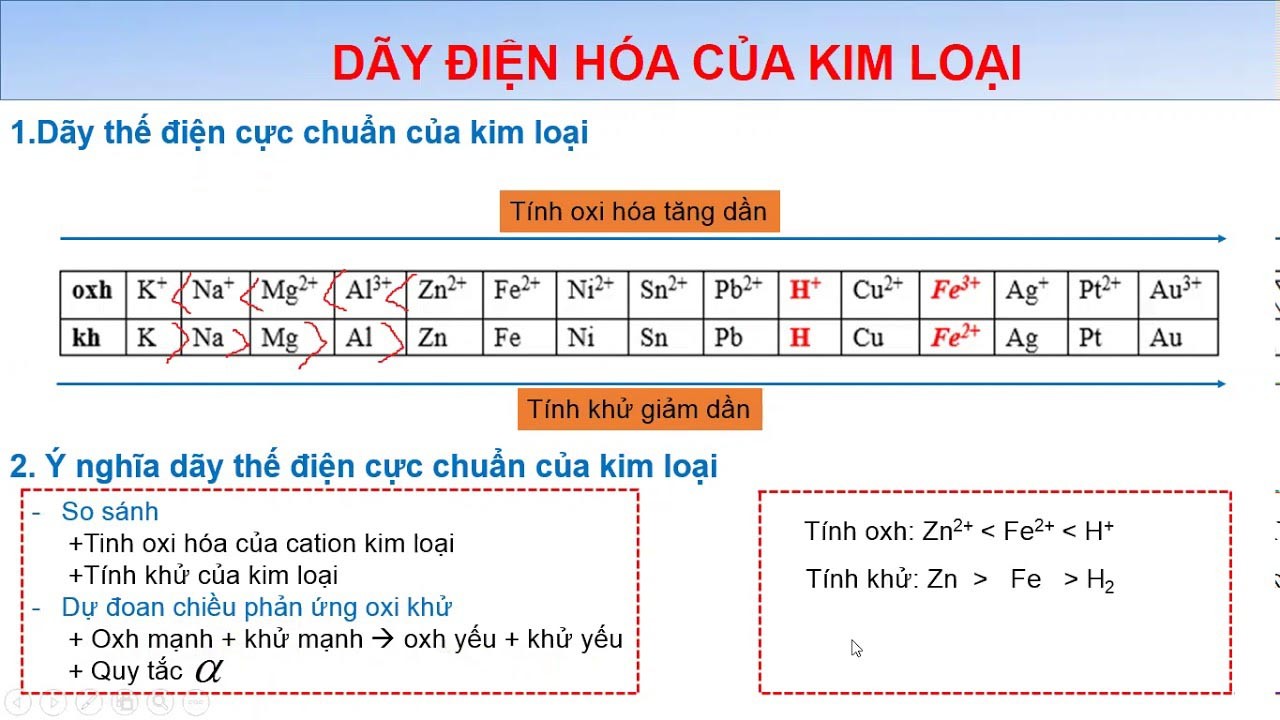
Định nghĩa hàng điện hóa của sắt kẽm kim loại là phần đa cặp oxi hóa – khử của kim loại được sắp xếp theo chiều tăng mạnh tính lão hóa của ion sắt kẽm kim loại và sút dần của tính khử kim loại.
2. Hàng điện hóa kim loại khá đầy đủ nhất
Sắp xếp theo tính lão hóa của sắt kẽm kim loại tăng:
K+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Ni2+ Sn2+ Pb2+ H+ Cu2+ Ag+ Au3+
Săp xếp theo tính khử của kim loại tăng: K mãng cầu Mg Al Zn sắt Ni Sn Pb H Cu Ag Au


3. Ý nghĩa dãy điện hóa của kim loại
Dựa vào dãy điện hóa sắt kẽm kim loại ta rất có thể biết được các cặp hóa học nào sẽ công dụng được với nhau, thông qua đó sẽ dự đoán được phần đa yếu tố sau đây:
So sánh tính thoái hóa – khử: Tính oxi hóa của ion sắt kẽm kim loại Mn+càng dạn dĩ thì tính khử càng yếu với ngược lạiXác định được chiều phản ứng của oxi hóa – khử: dự đoán được chiều của phản nghịch ứng giữa hai cặp lão hóa – khử theo quy tắc alpha.Xét một cặp phản bội ứng lão hóa khử: chất khử khỏe mạnh + hóa học oxi hóa khỏe mạnh ; hóa học oxi hóa yếu hơn + hóa học khử yếu đuối hơn.
Ý nghĩa của hàng điện hóa kim loại
4. đặc điểm của kim loại trong hàng điện hóa
Dựa vào dãy điện hóa đầy đủ, bạn cũng có thể xác định được các đặc thù hóa học của các kim loại, đặc biệt là xác định được tính oxi hóa với tính khử.

Tính chất dãy điện hóa của sắt kẽm kim loại đầy đủ
4.1. Bội nghịch ứng với phi kim
Một số sắt kẽm kim loại trong hàng điện hóa có tham gia phản ứng với phi kim để tạp ra những muối tương ứng. Một trong những phi kim hay gặp mặt đó là oxi, clo, diêm sinh .
Ví dụ:
Kim nhiều loại + Clo: 2Fe + Cl2 -> 2FeCl3Kim một số loại + oxi: 4Al + O2 -> 2Al2O3Kim các loại + lưu huỳnh: Hg + S -> Hg
S
4.2. Làm phản ứng với axit
Khá nhiều kim loại tham gia bội nghịch ứng với những dung dịch axit tạo thành muối kết phù hợp với việc giải tỏa khí hoặc nước.
Ví dụ:
Fe + 2HCl -> Fe
Cl2 + H2 (HCl loãng)
3Cu + HNO3 -> 3Cu
SO4 +2NO + 4H2O, (HNO3 loãng)
4.3. Làm phản ứng với nước
Những kim loại thuộc nhóm IA, IIA tham gia phản ứng với nước tạo ra dung dịch kiềm và khí hidro.
Ví dụ:
2Na + 2H2O -> 2Na
OH + H2 (khí)
4.4. Bội nghịch ứng cùng với muối
Kim loại tác dụng với muối tạo thành muối new và sắt kẽm kim loại mới
Ví dụ:
Fe + Cu
SO4 -> Fe
SO4 + Cu
5. Cách đọc hàng điện hóa dễ thuộc
VIETCHEM chia sẻ một số giải pháp nhớ hàng điện hóa bằng những vần thơ. Những kim loại đứng trước gồm tính khử to gan lớn mật hơn những sắt kẽm kim loại đứng sau nó. đều cation tầm giá sau gồm tính lão hóa mạn hơn đầy đủ cation phía trước.

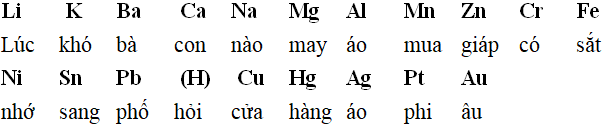

6. Bài bác tập về dãy điện hóa của kim loại

Bài tập hàng điện hóa kim loại
Bài tập 1: Hãy xác đính tính oxi hóa bớt dần tính của những ion sắt kẽm kim loại sau: Mg2+, Fe3+, Fe2+
Lời Giải: phụ thuộc dãy điện hóa đầy đủ, ta xác minh được tính oxi hóa giảm dần của những kim loại như sau: Fe3+, Fe2+, Mg2+.
Bài tập 2: xác minh chiều phản bội ứng giữa hai cặp Fe2+/ Fe với Cu2+/ Cu.
Lời Giải:
Theo chưa có người yêu tự ta gồm cặp Fe2+/ sắt đứng trước cặp Cu2+/ Cu. Áp dụng luật lệ alpha tác bao gồm chiều phản ứng sau:
Cu2+ + sắt → Cu + Fe2+
Như vậy, bội nghịch ứng xẩy ra theo chiều ion Cu2+ oxi hóa sắt để tạo ra thành Cu cùng Fe2+
Bài tập 3: Hãy tra cứu xem phản nghịch ứng nào tiếp sau đây không thể xảy ra.
A. Cu2++ Mg → Cu + Mg2+
B. Cu + Zn2+→ Cu2++ Zn
C. Cu2++ fe → Cu + Fe2+
D. Cu + 2Ag+→ Cu2++ 2Ag
Lời Giải: Đáp án B ko xảu ra bởi tính oxi hóa của Zn2+ yếu hơn Cu2+, vì thế Zn2+ tất yêu oxi hóa được Cu thành Cu2+.
Bài tập 4: Hãy xác minh tính oxi hóa bớt dần của những ion sắt kẽm kim loại sau đây: Mg2+, Fe3+, Fe2+, Cu2+, Ag+
Lời Giải:
Dựa vào hàng điện hóa ta xác minh được tính oxi hóa sút dần của các ion kim loại: Ag+, Fe3+, Cu2+, Fe2+, Mg2+.
Bài tập 5: Hãy xác minh tính khử sút dần của những kim loại sau: Fe, Al, Cu, Ag, Zn
Lời Giải:
Trong hàng điện hóa của kim loại, các chất được thu xếp theo đồ vật tự sau: Al, Zn, Fe, Cu, Ag.
Vậy tính khử sút dần đang lè: Al, Zn, Fe, Cu, Ag.
Bài tập 6: cho các kim các loại Zn, Cu, Mg, Al. Hãy xác minh tính thoái hóa của ion sắt kẽm kim loại tăng dần.
Lời Giải:
Dựa vào dãy điện hóa không thiếu thốn nhất ta gồm chiều bớt dần của tính khử là: Mg, Al, Zn, Cu.
Vậy chiều tăng vọt tính lão hóa của kim loại sẽ là: Mg2+ 3+ 2+ 2+
Bài tập 7: tiến hành ngâm đinh sắt trong 200 ml dung dịch Cu
SO4, sau khoản thời gian xảy ra phản bội ứng ta lấy đinh sắt ra rửa và làm cho khô thấy m
Fe tăng 0,8 gam. Hãy khẳng định nồng độ Cu
SO4.
Lời Giải:
Fe + Cu
SO4 → Fe
SO4 + Cu
Ta có: mđinh sắt tăng = m
Cu xuất hiện (bám vào) – m
Fe pư
Gọi số mol là a, ta được: 0,8 = 64a – 56a → a = 0,1 mol =>
CM(Cu
SO4) = 0,1/0,2 = 0,5M
Hy vọng với bài giảng hàng điện hóa của kim loại trên đây để giúp bạn đọc có thêm kiến thức và kỹ năng hóa học vận dụng vào làm bài tập một cách đúng chuẩn nhất. Bài viết liên quan các dạng bài bác hóa học tại wevsite vietchem.com.vn.
Dãy Điện Hóa Của kim loại là phần văn bản khá đặc biệt quan trọng và đòi hỏi sự đúng chuẩn cao khi chúng ta vận dụng nó. Vì chưng vậy trong bài viết dưới đây, ngoài việc gợi lưu giữ lại dãy điện hóa hãy cùng shop chúng tôi tham khảo một vài mẹo ghi nhớ nhé !
Tham khảo bài viết:
Ý nghĩa của hàng điện hóa của kim loại
– Dưa vào dãy điện hóa này ta đang biết được những cặp hóa học nào sẽ ảnh hưởng tác động được cùng với nhau, qua đó chúng ta sẽ có thể dự đoán được chiều của bội nghịch ứng hóa học thân hai cặp thoái hóa – khử theo nguyên tắc anpha.
+ hóa học oxi hóa khỏe mạnh hơn sẽ phản ứng oxi hóa chất khử táo tợn hơn ra đời 1 chất oxi hóa và 1 hóa học khử yếu đuối hơn.
+ Hoặc ( kim loại ở phía trên bên bắt buộc sẽ chức năng với sắt kẽm kim loại ở bên dưới bên trái của dãy điện hóa. Phản bội ứng này rất có thể hiểu đơn giản dễ dàng là dựa vào phản ứng hóa học sắt kẽm kim loại mạnh đang đẩy kim loại yếu hơn thoát ra khỏi muối ).
Dãy Điện Hóa Của kim loại Đầy Đủ Nhất
– hàng điện hóa sắt kẽm kim loại được sắp xếp theo chiều tăng ngày một nhiều tính oxi hóa của ion sắt kẽm kim loại và giảm dần tính khử của kim loại.

– Để dễ ợt ghi nhớ dãy điện hóa này, chúng ta cũng có thể chuyển qua thơ như
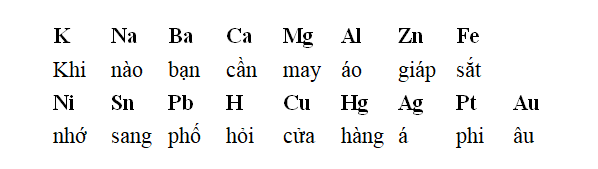
– Hoặc gồm thể:

– Hay để nhớ thêm vị trí của những cặp oxi hóa – khử của sắt kẽm kim loại sắt:
Bài thơ ghi nhớ hàng Điện Hóa Kim Loại
“ Mấy lời về dãy điện hóa ”
MẤY LỜI VỀ DÃY ĐIỆN HÓA
Dãy điện hóa O sau khử trước (1)
Phản ứng theo quy ước alpha
Nhưng rất cần được hiểu sâu xa
Trước sau chân thành và ý nghĩa mới là thành công
Kali, Can, Nát tiên phong
Ma, Nhôm, Man, Kẽm tiếp không chịu đựng hèn
Sắt rồi Cô mang lại Niken
Thiếc, Chì dẫu chậm trễ cũng tức khắc theo chân
Hiđro, Đồng, Bạc, Thủy ngân,
Bạch kim, vàng nữa chịu đựng phần đứng sau.
Ba kim (loại) mạnh mẽ nhất ở đầu
Vào dung dịch muối nước đâu “hủy liền”.
Khí bay, muối lại gặp mặt kiềm,
Đổi trao phản nghịch ứng là quyền bọn chúng thôi.
Các kim loại khác dễ dàng rồi,
Vào dung dịch muối trước thời đẩy sau.
Với axit, lưu giữ bảo nhau:
Khử được hát cộng (H+), đề xuất đâu dễ dàng dàng.
Xem thêm: Mẹ Kế Đứng Hình Khi Thấy Bạn Trai Và Con Trai Với Con Gái Hôn Nhau
Từ Đồng cho tới cuối hàng,
Sau Hiđro đấy, chẳng tung chút nào.
Vài lời bàn bạc, đổi trao,
Vun cây “Vườn Hóa” vui làm sao vui hơn