Tài liệu Giáo viên
Lớp 2Lớp 2 - Kết nối tri thức
Lớp 2 - Chân trời sáng tạo
Lớp 2 - Cánh diều
Tài liệu Giáo viên
Lớp 3Lớp 3 - Kết nối tri thức
Lớp 3 - Chân trời sáng tạo
Lớp 3 - Cánh diều
Tài liệu Giáo viên
Tài liệu Giáo viên
Lớp 4Lớp 4 - Kết nối tri thức
Lớp 4 - Chân trời sáng tạo
Lớp 4 - Cánh diều
Tiếng Anh lớp 4
Tài liệu Giáo viên
Lớp 5Sách giáo khoa
Sách/Vở bài tập
Tài liệu Giáo viên
Lớp 6Lớp 6 - Kết nối tri thức
Lớp 6 - Chân trời sáng tạo
Lớp 6 - Cánh diều
Tiếng Anh
Tài liệu Giáo viên
Lớp 7Lớp 7 - Kết nối tri thức
Lớp 7 - Chân trời sáng tạo
Lớp 7 - Cánh diều
Tiếng Anh
Tài liệu Giáo viên
Lớp 8Lớp 8 - Kết nối tri thức
Lớp 8 - Chân trời sáng tạo
Lớp 8 - Cánh diều
Tiếng Anh
Tài liệu Giáo viên
Lớp 9Sách giáo khoa
Sách/Vở bài tập
Tài liệu Giáo viên
Lớp 10Lớp 10 - Kết nối tri thức
Lớp 10 - Chân trời sáng tạo
Lớp 10 - Cánh diều
Tiếng Anh
Tài liệu Giáo viên
Lớp 11Lớp 11 - Kết nối tri thức
Lớp 11 - Chân trời sáng tạo
Lớp 11 - Cánh diều
Tiếng Anh
Tài liệu Giáo viên
Lớp 12Sách giáo khoa
Sách/Vở bài tập
Tài liệu Giáo viên
Giáo viênLớp 1
Lớp 2
Lớp 3
Lớp 4
Lớp 5
Lớp 6
Lớp 7
Lớp 8
Lớp 9
Lớp 10
Lớp 11
Lớp 12

Các dạng bài tập Hóa học lớp 9Chương 1: Các loại hợp chất vô cơ
Chương 2: Kim loại
Chương 3: Phi kim. Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Chương 4: Hiđrocacbon. Nhiên liệu
Chương 5: Dẫn xuất của Hiđrocacbon. Polime
Tổng hợp các dạng bài tập Hóa học lớp 9 có lời giải chi tiết
Với môn Hóa học lớp 9, học sinh sẽ được làm quen với nhiều chất hóa học, khái niệm, công thức, ... nền tảng của môn Hóa học. Tài liệu tổng hợp các dạng bài tập Hóa học lớp 9 với đầy đủ phương pháp giải chi tiết, các bài tập tự luyện đa dạng ở nhiều mức độ giúp bạn biết cách giải các dạng bài tập môn Hóa học lớp 9 từ đó ôn tập và đạt điểm cao trong bài thi môn Hóa học 9.
Bạn đang xem: Các dạng bài tập hóa học lớp 9
Bài tập Oxit bazo tác dụng với axit có lời giải
I – LÝ THUYẾT VÀ PHƯƠNG PHÁP GIẢI
- Oxit bazơ tác dụng với axit (HCl; H2SO4 loãng …) tạo thành muối và nước.
Ví dụ:
Fe
O + H2SO4 loãng → Fe
SO4 + H2O
Cu
O + 2HCl → Cu
Cl2 + H2O
- Thông thường dùng phương pháp tính toán theo PTHH để giải bài tập:
+ Bước 1: Viết phương trình hóa học xảy ra.
+ Bước 2: Đặt các dữ kiện vào phương trình hóa học (có thể phải đặt ẩn, hoặc xác định chất dư theo từng bài).
+ Bước 3: Tính toán theo yêu cầu của đề bài.
- Ngoài ra, để giải toán có thể phối hợp áp dụng các phương pháp:
+ Bảo toàn khối lượng;
+ Tăng giảm khối lượng;
+ Bảo toàn nguyên tố;
+ Quy đổi …
- Một số phương trình thường gặp cần lưu ý:
2Fe
O + 4H2SO4 đặc → Fe2(SO4)3 + SO2 + 4H2O
2Fe3O4 + 10H2SO4 đặc → 3Fe2(SO4)3 + SO2 + 10H2O
II – VÍ DỤ MINH HỌA
Ví dụ 1: Cho 3,825 gam một oxit kim loại (trong đó kim loại có hóa trị II) tác dụng với dung dịch H2SO4 loãng, vừa đủ. Sau khi phản ứng kết thúc thu được dung dịch chứa 5,825 gam muối. Công thức hóa học của oxit là?
A. Ba
O.
B. Cu
O.
C. Fe
O.
D. Ca
O.
Hướng dẫn:
Đáp án A
Đặt oxit cần tìm là MO. Phương trình hóa học xảy ra:
MO + H2SO4 → MSO4 + H2O
Theo bài ra ta có:
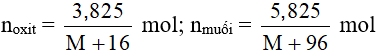
Theo PTHH có:
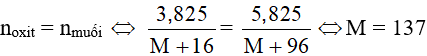
Vậy M là bari (Ba). Oxit cần tìm là Ba
O.
Ví dụ 2: Cho 8 (gam) Cu
O vào cốc chứa 20 gam dung dịch axit clohiđric 7,3%. Đến khi phản ứng xảy ra hoàn toàn, khối lượng muối có trong dung dịch thu được sau phản ứng là
A. 6,75 gam.
B. 13,50 gam.
C. 5,40 gam.
D. 2,7 gam.
Hướng dẫn:
Đáp án D.
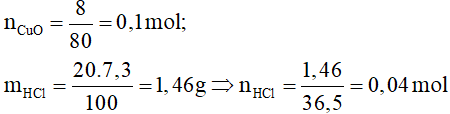
Phương trình hóa học:
Cu
O + 2HCl → Cu
Cl2 + H2O
0,1 0,04 mol
Có
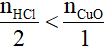
vậy sau phản ứng HCl hết; số mol Cu
Cl2 tính theo số mol HCl.
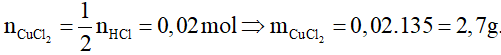
Ví dụ 3: Cho 2,8g hỗn hợp Cu
O, Mg
O, Fe2O3 tác dụng vừa đủ với 50 ml dd H2SO4 1M. Cô cạn dung dịch sau phản ứng thu được m gam muối khan. Giá trị của m là
A. 4,5g.
B. 7,6g.
C. 6,8g.
D. 7,4g.
Hướng dẫn:
Đáp án C.
Bảo toàn khối lượng:
mhh oxit + m
H2SO4 = mmuối + mnước sinh ra
Bảo toàn nguyên tố H có: nnước sinh ra = n
H2SO4
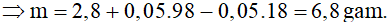
....................................
....................................
....................................
Bài tập Oxit axit tác dụng với bazo có lời giải
I – LÝ THUYẾT VÀ PHƯƠNG PHÁP GIẢI
- Oxit axit tác dụng với dung dịch bazơ tạo thành muối và nước.
Ví dụ:
1/ CO2 + Ca(OH)2 → Ca
CO3↓ + H2O
(Nếu CO2 dư tiếp tục có phản ứng: CO2 + Ca
CO3 + H2O → Ca(HCO3)2)
2/ CO2 + 2Na
OH → Na2CO3 + H2O
(Nếu CO2 dư tiếp tục có phản ứng: CO2 + Na2CO3 + H2O → 2Na
HCO3)
- Thông thường các oxit axit thường gặp trong chương trình là CO2 và SO2. Lưu ý, khi cho SO2 hoặc CO2 vào dung dịch kiềm tùy theo tỉ lệ về số mol mà sản phẩm thu được có thể là muối trung hòa, muối axit hoặc hỗn hợp cả hai muối.
- Phương pháp giải:
Bước 1: Tính toán các số mol theo dữ kiện đề bài.
Bước 2: Xác định sản phẩm thu được sau phản ứng (dựa vào tỉ lệ mol; hoặc dữ kiện đề bài cho).
Bước 3: Viết các phương trình hóa học xảy ra (nếu cần thiết).
Bước 4. Tính toán theo yêu cầu đề bài (nếu có).
- Chú ý cách xác định sản phẩm phản ứng dựa vào tỉ lệ số mol:
Bài toán 1: Dẫn khí CO2 hoặc SO2 vào dung dịch Na
OH; KOH … (kim loại trong bazơ có hóa trị I)
Đặt
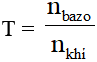
+ Nếu T = 2: Sau phản ứng chỉ thu được muối trung hòa, các chất tham gia phản ứng đều hết.
+ Nếu T > 2: Sau phản ứng thu được muối trung hòa, bazơ dư.
+ Nếu T = 1: Sau phản ứng chỉ thu được muối axit, các chất tham gia phản ứng đều hết.
+ Nếu T 2 hoặc SO2 vào dung dịch Ca(OH)2 ; Ba(OH)2 … (kim loại trong bazơ có hóa trị II)
Đặt
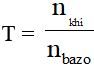
+ Nếu T = 2: Sau phản ứng thu được muối axit; các chất tham gia phản ứng đều hết.
+ Nếu T > 2: Sau phản ứng chỉ thu được muối axit; oxit axit dư.
+ Nếu T = 1: Sau phản ứng chỉ thu được muối trung hòa; các chất tham gia phản ứng đều hết.
+ Nếu T 2 (đktc) vào dung dịch nước vôi trong có chứa 0,075 mol Ca(OH)2. Sau phản ứng thu được
A. Ca
CO3.
B. Ca(HCO3)2.
C. Ca
CO3 và Ca(HCO3)2.
D. Ca
CO3 và Ca(OH)2 dư.
Hướng dẫn:
Đáp án C
Đặt
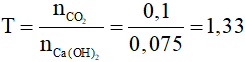
Có 1 3 và Ca(HCO3)2.
Ví dụ 2: Cho 2,24 lít CO2 (đktc) tác dụng với dung dịch Ba(OH)2 dư. Khối lượng chất kết tủa thu được là
A. 19,7 gam.
B. 9,85 gam.
C. 1,97 gam.
D. 17,9 gam.
Hướng dẫn:
Đáp án A
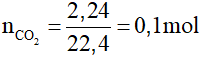
Do Ba(OH)2 dư nên sản phẩm thu được là muối trung hòa:
Phương trình hóa học:
CO2 + Ba(OH)2 dư → Ba
CO3 ↓ + H2O
0,1…………………..0,1 mol
→ m↓ = 0,1.197 = 19,7 gam.
....................................
....................................
....................................
Bài tập Muối tác dụng với muối có lời giải
I – LÝ THUYẾT VÀ PHƯƠNG PHÁP GIẢI
- Phản ứng xảy ra giữa hai dung dịch muối thường là phản ứng trao đổi. Hai dung dịch muối có thể tác dụng với nhau để tạo thành hai muối mới.
Dung dịch muối 1 + Dung dịch muối 2 → 2 muối mới.
Ví dụ:
Ba
Cl2 + Cu
SO4 → Ba
SO4 ↓ + Cu
Cl2
Na
Cl + Ag
NO3 → Ag
Cl↓ + Na
NO3
- Điều kiện để xảy ra phản ứng trao đổi giữa hai dung dịch muối:
+ Hai muối tham gia phản ứng phải tan.
+ Sản phẩm tạo thành phải có kết tủa hoặc chất dễ bay hơi.
- Phương pháp giải:
Bước 1: Tính các số mol của các chất mà đề bài cho dữ kiện (hoặc đặt ẩn tùy theo từng bài).
Bước 2. Viết các phương trình hoá học xảy ra.
Bước 3. Xác định chất dư (nếu có) và tính toán theo yêu cầu của đề bài.
Ngoài ra có thể phối hợp áp dụng định luật bảo toàn khối lượng, định luật bảo toàn nguyên tố, ... để giải quyết bài toán.
- Một số phản ứng giữa hai muối nhưng không là phản ứng trao đổi, cần lưu ý:
Fe(NO3)2 + Ag
NO3 → Fe(NO3)3 + Ag↓
2Fe
Cl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 6Na
Cl + 3CO2 ↑
II – MỘT SỐ VÍ DỤ MINH HỌA
Ví dụ 1. Dãy gồm các muối tác dụng với dung dịch Ba
Cl2 là
A. Na2CO3, Na2SO3, Na
Cl.
B. Na2SO4; K2CO3; Ag
NO3.
C. Ca
CO3, Na2CO3, Mg
Cl2.
D. Ag
NO3, Na2CO3, Cu(NO3)2.
Hướng dẫn giải
Đáp án B
Ba
Cl2 + Na2SO4 → Ba
SO4 ↓ + 2Na
Cl
Ba
Cl2 + K2CO3 → Ba
CO3 ↓ + 2KCl
Ba
Cl2 + 2Ag
NO3 → 2Ag
Cl ↓ + Ba(NO3)2.
Ví dụ 2: Cho 20ml dung dịch Na
Cl 1M vào lượng dư dung dịch Ag
NO3. Đến khi phản ứng xảy ra hoàn toàn khối lượng kết tủa tạo thành là
Đề cương ôn tập học kì I môn Hóa học lớp 9 đưa ra những trọng tâm cần ôn tập trong môn Hóa học lớp 9. Đề cương ôn thi học kì 1 môn Hóa học lớp 9 này gồm các dạng bài tập giúp các bạn ôn tập là củng cố kiến thức hiệu quả, từ đó đạt kết quả cao trong kì thi học kì 1 sắp tới, mời các bạn tham khảo.
A. Tài liệu ôn tập học kì 1 Hóa 9
B. Đề cương ôn tập học kì 1 Hóa 9
I. Viết các phương trình hóa học thực hiện dãy chuyển hóa
a) Al → Al2O3 → Al(NO3)3 → Al(OH)3 → Na
Đáp án hướng dẫn giải
1) 4Al + 3O2

2) Al2O3 + 6HNO3 → 2Al(NO3)3 + 3H2O
3) Al(NO3)3 + 3NH3 + 3H2O → Al(OH)3 + 3NH4NO3
4) Al(OH)3 + Na
OH → Na
5) K
6) 2Al(OH)3 → 2Al2O3 + 3H2O
7) Al2O3 + 2Na
OH + 3H2O → 2Na
8) 2K
9) Al2(SO4)3 + K2SO4 + 24H2O → 2KAl(SO4)2.12H2O
c. Fe
S2 → SO2 → SO3 → H2SO4 → Cu
SO4 → Na2SO4 → Na
OH → Na2Zn
O2.
Đáp án hướng dẫn giải
4Fe
S2 + 11O2

2SO2 + O2

SO3 + H2O → H2SO4
Cu
O + H2SO4 → Cu
SO4 + H2O
Cu
SO4 + 2Na
OH → Cu(OH)2↓+ Na2SO4
Na2SO4 + Ba(OH)2 → Ba
SO4↓+ 2Na
OH
Zn + 2Na
OH → Na2Zn
O2 + H2↑
d. Mg → Mg
SO4 → Mg(OH)2 → Mg
O → Mg
Cl2 → Mg(NO3)2 → Mg
CO3 → Mg
O
Mg + H2SO4 → Mg
SO4 + H2
Mg
SO4 + Na
OH → Mg(OH)2 + Na2SO4
Mg(OH)2 → Mg
O + H2O
Mg
O + 2HCl → Mg
Cl2 + H2O
Mg
Cl2 + 2Ag
NO3 → Mg(NO3)2 + 2Ag
Cl
Mg(NO3)2 + Ca
CO3 → Mg
CO3 + Ca(NO3)2
Mg
CO3 → Mg
O + CO2
II. Nhận biết các chất sau bằng phương pháp hóa học
1. Các chất rắn
a) Ba
O, Mg
O, Cu
O
b) Cu
O, Al, Mg
O, Ag
c) Ca
O, Na2O, Mg
O và P2O5
d) Na2O, Ca
O, Ag2O, Al2O3, Fe2O3, Mn
O2, Cu
O.
e) P2O5, Na2CO3, Na
Cl, Mg
CO3
f) Na
OH, KNO3, Ca
CO3, Mg
O, P2O5, Ba
SO4
Hướng dẫn giải
a) Ba
O, Mg
O, Cu
O
Trích lần lượt các chất ra làm mẫu thử
Cho H2O vào lần lượt từng mẫu thử , mẫu nào tạo ra kết tủa trắng lad Mg
O, tạo ra kết tủa xanh lơ là Cu(OH)2, phản ứng bình thường là Ba
O
Ba
O + H2O → Ba(OH)2
Mg
O + H2O → Mg(OH)2
Cu
O + H2O → Cu(OH)2
b) Cu
O, Al, Mg
O, Ag
Trích lần lượt các chất ra làm mẫu thử
Cho H2O vào lần lượt các mẫu thử , mẫu thử nào xuất hiện kết tủa trắng là Mg
O , xuất hiện kết tủa xanh lơ là Cu
O , xuất hiện kết tủa keo trắng và có khí bay ra là Al, còn ko tác dụng được là Ag
Mg
O + H2O → Mg(OH)2
Cu
O + H2O → Cu(OH)2
Al + H2O → Al(OH)3 + H2
c) Ca
O, Na2O, Mg
O và P2O5
Trích mỗi chất một ít làm mẫu thử, lần lượt cho vào nước:
+ Chất không tan là Mg
O
+ Chất tan là Na2O, Ca
O, và P2O5
Phương trình hóa học
Na2O + H2O → 2Na
OH
Ca
O + H2O → Ca(OH)2
P2O5 + 3H2O → 2H3PO4
Cho quỳ tím vào dung dịch thu được
+ Chất làm quỳ tím hóa đỏ là H3PO4 → chất ban đầu là P2O5
+ Chất làm quỳ tím hóa xanh là Na
OH và Ca(OH)2.
Sục khí CO2 qua 2 dung dịch làm quỳ tím hóa xanh:
+ Dung dịch có kết tủa trắng là Ca(OH)2 → chất ban đầu là Ca
O:
Ca(OH)2 + CO2 → Ca
CO3 + H2O
+ Dung dịch không có hiện tượng là Na
OH → chất ban đầu là Na2O:
2Na
OH + CO2 → Na2CO3 + H2O
d) Na2O, Ca
O, Ag2O, Al2O3, Fe2O3, Mn
O2, Cu
O.
Lấy mẫu thử của 8 chất bột rồi dùng dd HCl đặc để phân biệt:
Mẫu thử nào tan và xuất hiện kết tủa màu trắng là Ag2OAg2O + 2HCl → 2Ag
Cl + H2O
O2.
Mn
O2 + 4HCl(đặc) → Mn
Cl2 + Cl2 + 2H2O
Fe2O3 + 6HCl → 2Fe
Cl3 + 3H2O
Mẫu thử nào tan và xuất hiện dung dịch có màu xanh là Cu
O
Cu
O + 2HCl → Cu
Cl2 + H2O
Mẫu thử nào tan và xuất hiện dung dịch không màu Na2O, Ca
O, Al2O3.
Na2O + 2HCl → 2Na
Cl + H2O
Ca
O + 2HCl → Ca
Cl2 + H2O
Al2O3 + 6HCl → 2Al
Cl3 + 3H2O
Dùng nước có pha dd phenolphtalein vào ba mẫu thử chất bột của Na2O, Ca
O, Al2O3.
Mẫu thử nào không tan là Al2O3
Mẫu thử nào tan và làm dd phenolphtalein hóa hồng là Ca
O, Na2O
Ca
O + H2O → Ca(OH)2
Na2O + H2O → 2Na
OH
Dùng dung dịch H2SO4 vào dung dịch vừa tạo thành của Ca
O, Na2O
Mẫu thử nào xuất hiện kết tủa trắng thì ban đầu là Ca
O
Ca(OH)2 + H2SO4 → Ca
SO4 + 2H2O
Mẫu thử không hiện tượng thì ban đầu là Na2O
2. Các dung dịch
a) HNO3, H2SO4, HCl, K2SO4, KNO3, KOH, Ba(OH)2.
b) HCl, Na
OH, Na2SO4, Na
Cl.
c) HCl, H2SO4, Na
Cl, Na2CO3
d) Na
OH, Ba
Cl2, Ba(OH)2, Na
Cl
e) Na2SO4, K2CO3, Ba
Cl2, Ag
NO3
f) KNO3, Cu(NO3)2, Ag
NO3, Fe(NO3)3
3. Các chất khí
a) CO2, H2, N2, CO, O2, Cl2
b) CO, CO2, SO2, SO3, H2
c) CO, CO2, SO2
4. Các kim loại
Al, Fe, Cu, Zn
III. Bài toán hỗn hợp
Câu 1. Hòa tan 8,9 gam hỗn hợp Mg, Zn vào lượng vừa đủ dung dịch H2SO4 0,2M thu được dung dịch A và 4,48 lít khí H2 ở đktc.
a. Tính thành phần % theo khối lượng của mỗi kim loại?
b. Tính thể tích dung dịch axit đã dùng?
Đáp án hướng dẫn giải chi tiết
n
H2 = 4,48/22,4 = 0,2 mol
Gọi x, y lần lượt là số mol của Mg và Zn
Phương trình phản ứng
Mg + H2SO4 → Mg
SO4 + H2
x → x → x → x mol
Zn + H2SO4 → Zn
SO4 + H2
y → y → y → y mol
n
H2 = x + y = 0,2 (1)
Mặt khác ta có
24x + 65y = 8,9 (2)
Giải hệ phương trình (1) và (2) ta được
=> x = 0,1; y= 0,1
n
Mg = 0,1 mol
m
Mg = 0,1.24 = 2,4
%m
Mg = 2,4.100/8.9 = 26.97%
%m
Zn = 100 - 29,97= 73.03%
b) n
H2SO4 = 0,2 mol
Vdd = 0,2/0,2 = 1 (lít)
Câu 2. Cho 27 gam hỗn hợp Al và Zn
O vào dung dịch HCl 29,2% (vừa đủ) thì thu được 13,44 lít khí (đktc)
a) Tính % theo khối lượng mỗi chất trong hỗn hợp ban đầu?
b) Tính khối lượng dung dịch HCl cần dùng?
c) Tính nồng độ % các muối có trong dung dịch thu được sau phản ứng?
Đáp án hướng dẫn giải chi tiết
2Al + 6HCl → 2Al
Cl3 + 3H2 (1)
Zn
O + 2HCl → Zn
Cl2 + H2O (2)
a) n
H2= 13,44/22.4 = 0,6(mol) → m
H2 = 0,6.2 = 1,2(g)
Theo phương trình hóa học:
n
Al = 2/3 n
H2 = 2/3 . 0,6= 0,4(mol)
→ m
Al = 0,4 . 27 = 10,8(g)
→ m
Zn
O = 27 - 10,8= 16,2(g)
b) n
Zn
O = 16,2/81=0,2(mol)
Theo PTHH (2): n
HCl = 2n
Zn
O= 2.0,2 = 0,4 (mol)
Theo PTHH (1) : n
HCl = 2n
H2= 2.0,6 = 1,2 (mol)
→ Σn
HCl = 0,4 + 1,2 = 1,6 (mol)
→ m
HCl = 1,6.36,5 = 58,4(g)
→ mdd
HCl = 58,4.100/29,2 = 200(g)
c) Theo PTHH (1):
n
Al
Cl3 = 2/3 n
H2 = 2/3 . 0,6= 0,4(mol)
→ m
Al
Cl3=0,4.133,5 = 53,4(g)
mdd sau phản ứng= m
A + mdd
HCl - m
H2 =27+ 200 - 1,2 = 225,8(g)
→C% Al
Cl3 = 53,4.100%/225,8 = 20,88%
Theo PTHH (2)
n
Zn
Cl2 =n
Zn
O= 0,2(mol) → m
Zn
Cl2=0,2.136=27,2(g)
→ C% Zn
Cl2= 27,2.100%/255,8=10,63%
Câu 3. Dẫn 10 lít hỗn hợp khí CO và SO2 qua dung dịch Ba(OH)2 dư. Sau phản ứng thu được 81,375 gam kết tủa. Tính thành phần % theo thể tích mỗi khí trong hỗn hợp ban đầu? (Biết thể tích các khí đo ở đktc).
Câu 4. Hòa tan hoàn toàn 12,1 gam hỗn hợp bột Cu
O và Zn
O cần 73,5 gam dung dịch H2SO4 20%
a) Viết các phương trình hóa học
b) Tính phần trăm theo khối lượng của mỗi oxit trong hỗn hợp ban đầu
Câu 5. Cho 17,5 gam hỗn hợp gồm 3 kim loại Fe, Al, Zn tan hoàn toàn trong dung dịch H2SO4 0,5M, ta đthu 11,2 lít H2 (đktc). Tính thể tích dung dịch axit tối thiểu phải dùng và khối lượng muối khan thu được
IV. Xác định công thức hóa học của các chất vô cơ
Câu 1. Trong thành phần oxit của kim loại R hóa trị III có chứa 30% Oxi theo khối lượng. Hãy xác định tên kim loại và công thức oxit? Tính thể tích dung dịch HCl 2M đủ để hòa tan 6,4 gam oxit kim loại nói trên?
Câu 2. Biết rằng 300ml dung dịch HCl vừa đủ hòa tan hết 5,1 gam một oxit của kim loại M chưa rõ hóa trị. Hãy xác định tên kim loại và công thức oxit?
Câu 3. Đốt cháy hoàn toàn một lượng kim loại hóa trị II thu được 8 gam oxit. Cho lượng oxit này tác dụng hoàn toàn với 200 ml dung dịch HCl 2M. Xác định tên kim loại và công thức hóa học của axit.
V. Bài toán tăng giảm khối lượng
Câu 1. Cho lá kẽm có khối lượng 50 gam vào dung dịch Cu
SO4. Sau khi phản ứng kết thúc thì khối lượng lá kẽm là 49,82 gam.
Tính khối lượng kẽm đã tham gia phản ứng (giả sử toàn bộ kim loại Cu tạo thành đều bám vào lá kẽm)?
Câu 2. Nhúng 594 gam Al vào dung dịch Ag
NO3 2M. Sau thời gian khối lượng thanh Al tăng 5% so với ban đầu. (Giả sử toàn bộ kim loại Ag tạo thành đều bám vào thanh nhôm)
a) Tính khối lượng Al tham gia phản ứng?
b) Tính khối lượng Ag thu được?
c) Tính khối lượng muối Al tạo ra?
Câu 3. Cho m(g) hỗn hợp Zn và Fe vào lượng dư dung dịch Cu
SO4. Sau khi kết thúc phản ứng lọc bỏ phần dung dịch thu được m (g) bột rắn. Tính thành phần % theo khối lượng của Zn trong hỗn hợp ban đầu?
Câu 4. Ḥòa tan m gam hỗn hợp A gồm Fe và kim loại M (hóa trị II) trong dung dịch HCl dư thu được 1,008 lít khí (đktc) và dung dịch chứa 4,575 gam muối khan. Tính giá trị của m?
Câu 5. Nhúng một thanh sắt nặng 8 gam vào 500 ml dung dịch Cu
SO4 2M. Sau một thời gian lấy lá sắt ra cân lại thấy nặng 8,8 gam. Xem thể tích dung dịch không thay đổi thì nồng độ mol/lit của Cu
SO4 trong dung dịch sau phản ứng là bao nhiêu?
VI. Phản ứng tạo muối axit – muối trung hòa
Câu 1. Cho 224 ml khí CO2 (đktc) hấp thụ hết trong 100ml dung dịch KOH 0,2M. Tính khối lượng của muối tạo thành?
Câu 2. Sục V lít khí CO2 (đktc) vào 2 lít dung dịch Ca(OH)2 0,05M, thu được 7,5 gam kếttủa. Các phản ứng xảy ra hoàn toàn. Tính giá trị của V?
Câu 3. Hấp thụ hoàn toàn 0,16 mol CO2 vào 2 lít dd Ca(OH)2 0,05 M thu được kết tủa X và dd Y. Cho biết khổi lượng dd Y tăng hay giảm bao nhiêu so với dung dịch Ca(OH)2 ban đầu?
Câu 4. Cho V lít (đktc) CO2 tác dụng với 200 ml dung dịch Ca(OH)2 1M thu được 10 gam kết tủa. Vậy thể tích V của CO2 là
VII. Bài toán có lượng chất dư
Câu 1. Cho 180 gam dung dịch H2SO4 15% vào 320 gam dung dịch Ba
Cl2 10%. Tính nồng độ % các chất trong dung dịch thu được sau phản ứng?
Câu 2. Trộn 100ml dung dịch Mg
Cl2 2M với 150 ml dung dịch Ba(OH)2 1,5M được dung dịch A (D=1,12g/ml) và kết tủa B. Đem kết tủa B nung nóng ở nhiệt độ cao đến khối lượng không đổi thu được chất rắn D.
a. Tính khối lượng rắn D.
b. Xác định nồng độ mol/l và nồng độ % của dung dịch A (xem thể tích dung dịch thay đổi không đáng kể
VIII. Bài toán sử dụng hiệu suất
Câu 1. Cho 1,12 lít khí SO2 (đktc) lội qua dung dịch Ca(OH)2 dư thu được một kết tủa. Tính khối lượng kết tủa này biết hiệu suất phản ứng là 80%?
Câu 2. Tính khối lượng axit sunfuric 96% thu được từ 60Kg quặng Pirit sắt nếu hiệu suất quá trình là 85%?
Câu 3. Từ 160 tấn quặng pirit sắt Fe
S2 (Chứa 40% lưu huỳnh) người ta sản xuất được 147 tấn axit sunfuric.
a) Tính hiệu suất quá trình sản xuất axit sunfuric
b) Tính khối lượng dung dịch H2SO4 49% thu được từ 147 tấn axit sunfuric đã sản xuất ở trên
Tài liệu vẫn còn mời các bạn ấn link TẢI VỀ bên dưới để xem trọn bộ tài liệu
....................................
Trên đây, Vn
Doc đã gửi tới các bạn Đề cương ôn tập học kì 1 môn Hóa học phần bài tập lớp 9. Hy vọng đây là tài liệu hữu ích giúp các bạn hệ thống được toàn bộ kiến thức được học trong học kì 1 môn Hóa học 9, từ đó chuẩn bị tốt cho kì thi học kì 1 sắp tới đạt kết quả cao.
Xem thêm: Cách Chia Cột Trong Word 2010 Theo Ý Muốn, Cách Chia Cột Trong Word Đều Và Điều Chỉnh Khoảng
Để chuẩn bị cho kì thi học kì 1 lớp 9 sắp tới, các em học sinh cần ôn tập theo đề cương, bên cạnh đó cần thực hành luyện đề để làm quen với nhiều dạng đề khác nhau cũng như nắm được cấu trúc đề thi. Chuyên mục Đề thi học kì 1 lớp 9 trên Vn
Doc tổng hợp đề thi của tất cả các môn, là tài liệu phong phú và hữu ích cho các em ôn tập và luyện đề. Đây cũng là tài liệu hay cho thầy cô tham khảo ra đề. Mời thầy cô và các em tham khảo.
Ngoài ra, Vn