Bài 30: lưu giữ huỳnh
Bài 31: Bài thực hành thực tế số 4. đặc điểm của oxi, lưu giữ huỳnh
Bài 32: Hiđro sunfua - diêm sinh đioxit - lưu hoàng trioxit
Bài 33: Axit sunfuric - muối hạt sunfat
Bài 34: Luyện tập: Oxi cùng lưu huỳnh
Bài 35: Bài thực hành số 5. đặc thù các hợp hóa học của lưu lại huỳnh
Xem toàn cục tài liệu Lớp 10: tại đây
Giải bài xích Tập hóa học 10 – bài xích 30: lưu hoàng giúp HS giải bài xích tập, hỗ trợ cho những em một hệ thống kiến thức và hiện ra thói quen học tập tập làm việc khoa học, làm nền tảng cho việc phát triển năng lực nhận thức, năng lực hành động:
Bài 1 (trang 132 SGK Hóa 10): lưu huỳnh tính năng với aixt sunfuric đặc, nóng:S + 2H2SO4 → 3SO2 + 2H2O
Trong bội nghịch ứng này, tỉ lệ số nguyên tử lưu huỳnh bị khử : số nguyên tử lưu huỳnh bị lão hóa là:
A. 1 : 2.
Bạn đang xem: Giải bài tập hóa 10 bài 30
B. 1 : 3.
C. 3 : 1.
D. 2 : 1.
Chọn câu trả lời đúng.
Lời giải:
D đúng.
S là hóa học khử (chất bị oxi hóa) ⇒ Số nguyên tử S bị oxi hóa là 1
H2SO4 là chất oxi hóa (chất bị khử) ⇒ Số nguyên tử S bị khử là 2
⇒ tỉ lệ thành phần số nguyên tử S bị khử: số nguyên tử S bị thoái hóa là: 2:1
Bài 2 (trang 132 SGK Hóa 10): Dãy đối chọi chất nào dưới đây vừa gồm tính lão hóa vừa bao gồm tính khử?A. Cl2 , O3, S.
B. S, Cl2, Br2.
C. Na, F2, S.
D. Br2, O2, Ca.
Lời giải:
B đúng.
Bài 3 (trang 132 SGK Hóa 10): có thể dự đoán sự biến đổi như thay nào về cân nặng riêng, về ánh nắng mặt trời nóng chảy khi giữ lưu huỳnh đối kháng tà (SB ) dài ngày ở nhiệt độ phòng?Lời giải:
Ở ánh sáng phòng, tất cả sự chuyển hóa từ Sβ → Sα vậy khi duy trì Sβ vài ba ngày ở ánh sáng phòng thì:
– trọng lượng riêng của lưu hoàng tăng dần.
– ánh nắng mặt trời nóng chảy của lưu giữ huỳnh sút dần.
Bài 4 (trang 132 SGK Hóa 10): Đun lạnh một hỗn hợp gồm tất cả 0,650g bột kẽm với 0,224g bột lưu hoàng trong ống thử đậy kín không có không khí. Sau phản ứng, fan ta thu được hóa học nào vào ống nghiệm? khối lượng là bao nhiêu?Lời giải:
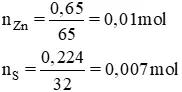
⇒ S làm phản ứng hết, Zn phản nghịch ứng dư
Phương trình hóa học của bội nghịch ứng
Zn + S
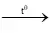
S
n
Zn bội phản ứng = 0,007 mol ⇒ n
Zn
S = 0,007 mol.
Khối lượng những chất sau phản nghịch ứng:
m
Zn dư = (0,01 – 0,007) × 65 = 0,195g.
m
Zn
S = 0,007 × 97 = 0,679g.
a) Viết các phương trình hóa học của phản ứng xảy ra.
Nội dung bài học Lưu huỳnh tìm hiểu về kết cấu phân tử và đặc điểm vật lí của lưu huỳnh đổi khác như ráng nào theo nhiệt độ. đặc thù hóa học của giữ huỳnh bao gồm gì đặc biệt? lưu giữ huỳnh gồm có ứng dụng đặc trưng nào?
1. Cầm tắt lý thuyết
1.1.Vị trí, cấu hình electron nguyên tử
1.2.Tính hóa học vật lí
1.3.Tính chất hóa học
1.4.Ứng dụng của giữ huỳnh
1.5.Trạng thái thoải mái và tự nhiên và chế tạo lưu huỳnh
1.6.Tổng kết
2. Bài tập minh hoạ
3. Luyện tập Bài 30 chất hóa học 10
3.1. Trắc nghiệm
3.2. Bài bác tập SGK và Nâng cao
4. Hỏi đáp về
Bài 30 Chương 6 hóa học 10
Vị trí của nguyên tố S:Z = 16Chu kì 3Nhóm VI ACấu hình e : 1s22s22p63s23p4Có 6 e ở lớp bên ngoài cùng
Có 2 e độc thân
1.2.1. Hai dạng thù hình của lưu huỳnh
Dạng thù hình là những 1-1 chất khác nhau của 1 nguyên tố hóa học. Ví dụ: O2 với O3.
Các dạng thù hình của S ko tan vào nước mà lại tan các trong benzen, dầu hỏa.

Hình 1:2 dạng thù hình của giữ huỳnh
Cấu tạo thành tinh thể và đặc thù vật lí | Lưu huỳnh tà phương (Sα) | Lưu huỳnh đối kháng tà (Sβ) | Kết luận |
Cấu tạo tinh thể | 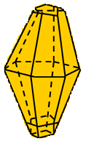 | 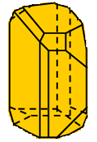 | Cấu chế tạo khác nhau |
Khối lượng riêng | 2,07g/cm3 | 1,96g/cm3 | Sα > Sβ |
Nhiệt nhiệt độ chảy | 1130C | 1190C | Sα β |
Nhiệt độ bền | 0C | 95,50C → 1190C | Sα β |
Nhiệt độ | Trạng thái | Màu | Cấu chế tác phân tử | |
 | 0 | Rắn | Vàng | S8, mạch vòng tinh thể Sβ -Sα |
 | 1190 | Lỏng | Vàng | S8, mạch vòng linh hoạt |
 | >1870 | Quánh | Nâu đỏ | S8 vòng → chuỗi S8 → Sn |
 | >4450 14000 17000 | Hơi Hơi Hơi | Da cam | S6, S4 S2 S |
1.3. đặc điểm hóa học
Cấu hình electron của S: 1s22s22p63s23p4S khi gia nhập phản ứng với kim loại hoặc Hidro, số lão hóa của S sẽ giảm từ 0 xuống -2.S khi gia nhập phản ứng với phi kim vận động mạnh hơn hoàn toàn như Oxi, Clo, Flo ... Số lão hóa của S tăng từ bỏ 0 lên +4 hoặc + 6


⇒Ở ánh sáng cao, giữ huỳnh tính năng với các kim loại tạo nên muối sunfua cùng với hiđro tạo ra khí hiđrosunfua, S bộc lộ tính oxi hóa.

Hình 1: Khi sức nóng kế vỡ, có thể sử dụng bột diêm sinh để sinh sản muối với thủy ngân,
tránh tương đối thủy ngân khiến độc.
1.3.2.Lưu huỳnh tác dụng với phi kim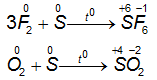
⇒Ở ánh sáng thích hợp, giữ huỳnh tác dụng với một vài phi kim mạnh khỏe hơn, S mô tả tính khử.
1.3.3.Lưu huỳnh tác dụng với những axit gồm tính oxi hóa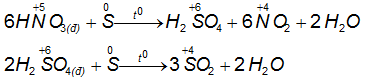
Video 1: bội phản ứng giữa lưu lại huỳnh và axit nitric đặc nóng
(chứng minh phản nghịch ứng bao gồm xảy ra bằng cách nhỏ vài giọt dd Ba
Cl2thấy kết tủa white color của Ba
SO4
⇒ lưu giữ huỳnh công dụng được với các axit có tính oxi hóa, S biểu lộ tính khử.
1.3.4. Kết luậnS vừa diễn tả tính thoái hóa (tác dụng với sắt kẽm kim loại và hiđro) vừa biểu lộ tính khử (tác dụng cùng với phi kim to gan hơn cùng axit gồm tính oxi hóa).Giải thích:S tất cả 6 e ở lớp ngoài cùng, nó giống như O, thuận lợi nhận 2 e nhằm đạt cấu hình bền chắc của khí hiếm. Độ âm điện của S là 2,58. Cho nên vì thế S biểu thị tính oxi hóa khi tính năng với những chất khử (kim loại, hiđro).Mặt khác, S ở trong chu kì 3 nên lớp bên ngoài cùng tất cả thêm phân lớp 3 chiều trống. Trong các phản ứng, S rất có thể ở tinh thần kích phù hợp và hoàn toàn có thể có 4, 6 e độc thân và S thuận lợi cho 4 hoặc 6 e. Vì vậy S mô tả tính khử khi công dụng với các chất gồm tính oxi hóa (phi kim mạnh mẽ hơn, một số trong những axit).S có các số oxi hóa: -2, 0, +4, +6
1.4. Ứng dụng của giữ huỳnh
Lưu huỳnh có rất nhiều ứng dụng đặc trưng trong các ngành công nghiệp:90% lượng sulfur khai tác được dùng làm sản xuất H2SO4.10% lượng lưu huỳnh sót lại được sử dụng để:Lưu hóa cao su;Sản xuất diêm, dược phẩm, phẩm nhuộm, chất trừ sâu, diệt nấm...S còn là 1 nguyên tố vi lượng cần thiết cho sự sống, S là nguyên tố của phân bón mang đến công nghiệp...Ngoài ra, S cùng rất C, KNO3 với tỉ lệ phù hợp được dùng làm sản xuất ra thuốc súng đen.
Phương trình phản bội ứng: S + 3C + 2KNO3 → K2S + 3CO2 + N2
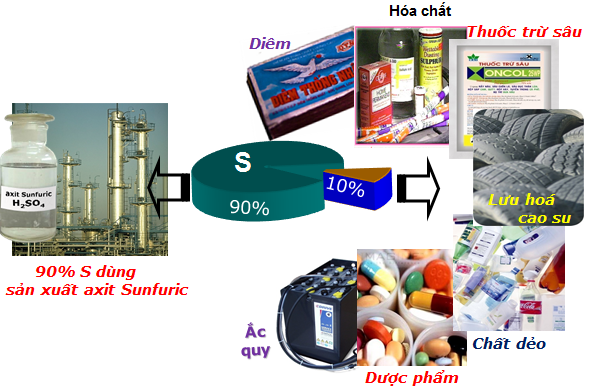
Hình 2:Ứng dụng của lưu giữ huỳnh
1.5. Trạng thái thoải mái và tự nhiên và chế tạo lưu huỳnh
Trạng thái tự nhiên của S:
Dạng solo chất: ở các mỏ giữ huỳnh, các mỏ công ty yếu tập trung gần các miệng núi lửa, suối nước nóng…Dạng hợp chất: muối hạt sunfat, muối hạt sunfua…Khai thác diêm sinh từ những mỏ lưu lại huỳnh: bạn ta dùng thiết bị đặc trưng để nén nước rất nóng (1700C) vào mỏ làm lưu huỳnh nóng chảy và đẩy lên mặt đất. Sau đó lưu huỳnh được tách bóc ra khỏi các tạp chất.
2 H2S + O2(thiếu)
2 H2S + SO2 → 2 H2O + 3 S
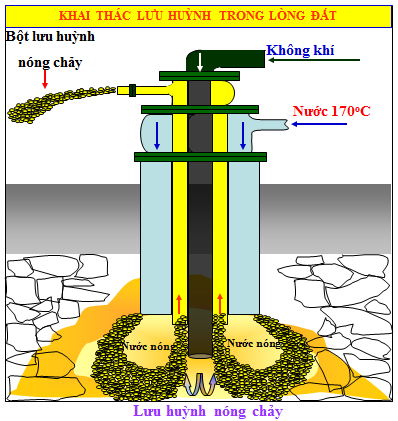
Hình 3:Thiết bi khai thác lưu huỳnh (phương pháp Frasch)
1.6. Tổng kết
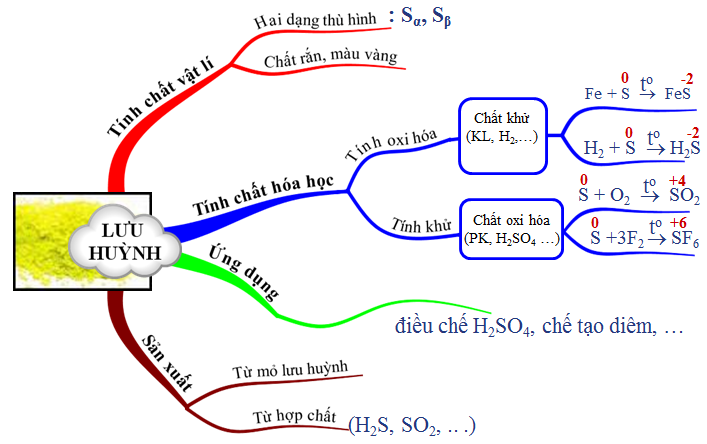
Hình 4:Sơ đồ bốn duy bài xích lưu huỳnh
Bài 1:
Vì sao nên hạn chế sử dụng măng khô, đũa sử dụng một lần, tăm tre?

Măng khô, đũa sử dụng 1 lần, tăm tre thường xuyên được xông giữ huỳnh để diệt mốc, ngăn ngừa mốc phát triển. Lưu hoàng gây dịch đường hô hấp. Quy trình xông thường vận khí SO2 bao gồm mùi giận dữ – đó chính là khí độc, có tác động tới môi trường, sức khỏe của fan chế đổi thay và fan sống xung quanh.
Bài 2:Đun nóng láo hợp gồm 11,2g bột sắt và 3,2g bột lưu giữ huỳnh, cho thành phầm tạo thành vào 500ml hỗn hợp HCl thu được hỗn thích hợp khí với dd A. Để th-nc HCl còn dư trong dd A yêu cầu dùng 250ml dung dịch Na
OH 0,1M. Tính nồng độ mol/l của dd HCl sẽ dùng.
Phương trình làm phản ứng:
Fe + S → Fe
S (1)Fe
S + 2HCl → Fe
Cl2 + H2S (2)Fe + 2HCl → Fe
Cl2 + H2 (3)HCl + Na
OH →Na
Cl + H2O (4)Số mol của sắt cùng lưu huỳnh là:
n
Fe=0,2 mol, n
S =0,1 mol.
Phản ứng xẩy ra thu được 0,1mol Fe
S với 0,1mol sắt dư .
Phương trình (4) n
Na
OH = n
HCl .
Vậy n
HClđã dùng là = 2n
Fe
S + 2n
Fe dư + n
Na
OH = 0,2 + 0,2 + 0,025 = 0,425 mol
Vậy centimet (HCl) = n/ v = 0,425/0,5 = 0,85M
Cho thành phầm tạo thành khi đun nóng láo hợp gồm 5,6g bột sắt và 1,6g bột S vào 500ml dd HCl thì thu được tất cả hổn hợp khí bay ra và 1 dd B. Năng suất phản ứng là 100%.a) Tính thành phần xác suất về thể tích từng khí vào hh khíb) Để trung hoà HCl còn quá trong dd A yêu cầu dùng 125ml dd Na
OH 0,1M. Tính cm HCl đã dùng.
Tính số mol từng chất
n
Fe = 0,1 moln
S= 0,05 mol
Fe + S
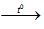
S⇒ S hết, fe dưn
Fe(dư) = 0,05mol
Fe + 2HCl → Fe
Cl2 + H20,05....0,1 ..............0,05Fe
S + 2HCl → Fe
Cl2 + H2S0,05......0,1.................0,05⇒ Vhh khí =22,4 . 0,1 = 2,24 lit
⇒Thành phần phần trăn từng khí là 1/2 H2S và 50% H2b)
n
Na
OH= 0,0125mol
Na
OH + HCl → Na
Cl + H2O0,0125 0,0125Ta có số mol HCl là =0,1+0,1+0,0125=0,2125,ol⇒ CMHCl = 0,2125/0,5 = 0,425M
Sau bài học kinh nghiệm cần nắm:
Lưu huỳnh trong tự nhiên tồn tại ở nhị dạng thù hình: diêm sinh tà phương (Sα) cùng lưu huỳnh đối chọi tà (Sβ).Ảnh hưởng trọn của ánh sáng đến cấu tạo phân tử và đặc thù vật lý của lưu lại huỳnh.Tính hóa chất cơ bản của là vừa tất cả tính oxi hóa vừa có tính khử và trong hợp hóa học lưu huỳnh tất cả số lão hóa là -2, +4, +6.Sự chuyển đổi về tính cấu trúc phân tử và đặc điểm vật lý của diêm sinh theo sức nóng độ.Nguyên nhân sulfur vừa gồm tính khử vừa có tính oxi hóa.So sánh đặc thù hóa học tập của oxi với lưu huỳnh.Tầm đặc biệt của lưu huỳnh trong cuộc sống.3.1. Trắc nghiệm
Bài chất vấn Trắc nghiệm hóa học 10 bài xích 30 có phương pháp và lời giải chi tiết giúp các em luyện tập và phát âm bài.
Câu 1:Đơn chất nào sau đây vừa bao gồm tính oxi hóa, vừa bao gồm tính khử?
A.O2B.O3C.SD.F2
Câu 2:
Phát biểu nào dưới đây chưa đúng:
Các em có thể hệ thống lại nội dung bài xích học trải qua phần giải đáp Giải bài bác tập chất hóa học 10 bài 30.
Xem thêm: Cách Sử Dụng Hàm Liệt Kê Các Giá Trị Trong Excel
bài xích tập 1 trang 132 SGK hóa học 10
bài xích tập 2 trang 132 SGK chất hóa học 10
bài xích tập 3 trang 132 SGK hóa học 10
bài xích tập 4 trang 132 SGK hóa học 10
bài xích tập 5 trang 132 SGK chất hóa học 10
bài xích tập 30.1 trang 66 SBT chất hóa học 10
bài tập 30.2 trang 66 SBT hóa học 10
bài xích tập 30.3 trang 66 SBT chất hóa học 10
bài xích tập 30.4 trang 66 SBT hóa học 10
bài tập 30.5 trang 67 SBT chất hóa học 10
bài tập 30.6 trang 67 SBT chất hóa học 10
bài bác tập 30.7 trang 67 SBT hóa học 10
bài xích tập 30.8 trang 67 SBT hóa học 10
bài bác tập 30.9 trang 67 SBT chất hóa học 10
bài tập 30.10 trang 68 SBT chất hóa học 10
bài xích tập 30.11 trang 68 SBT hóa học 10
bài tập 1 trang 172 SGK chất hóa học 10 nâng cao
bài tập 2 trang 172 SGK hóa học 10 nâng cao
bài tập 3 trang 172 SGK chất hóa học 10 nâng cao
bài xích tập 4 trang 172 SGK chất hóa học 10 nâng cao
4. Hỏi đáp về bài xích 30 Chương 6 hóa học 10
Trong quy trình học tập nếu có bất kì thắc mắc gì, những em hãy vướng lại lời nhắn sinh hoạt mục
Hỏi đápđể cùng cộng đồng Hóa docongtuong.edu.vn luận bàn và vấn đáp nhé.