Đề thi hóa học 8 học kì 1 bao gồm đáp án (5 đề) năm 2022 - 2023
Haylamdo soạn và đọc Đề thi chất hóa học 8 học kì 1 tất cả đáp án (5 đề) năm 2022 - 2023 được tổng hợp chọn lọc từ đề thi môn Hoá học tập 8 của những trường trên toàn nước sẽ giúp học viên có kế hoạch ôn luyện từ bỏ đó được điểm cao trong những bài thi Hoá học lớp 8.
Bạn đang xem: Đề thi học kì 1 hoá học lớp 8 năm 2022

Phòng giáo dục và đào tạo và Đào tạo thành .....
Đề thi 45 phút học kì 1
Môn: hóa học lớp 8
Thời gian làm cho bài: 45 phút
(Đề 1)
I. TRẮC NGHIỆM
Khoanh tròn chữ cái cho câu trả lời.
Câu 1: Trong phương pháp hóa học nào sau đây sắt có hóa trị III?
A. Fe
O
B. Fe2O3
C. Fe3O4
D. Fe
O hoặc Fe3O4
Câu 2: hiện tượng nào dưới đây là chuyển đổi hóa học?
A. Nước đá chảy chảy
B. Muối ăn tan vào nước tạo thành thành nước muối
C. động để trong lọ không bí mật bị bay hơi
D. Fe bị gỉ sét chế tạo ra thành fe oxit
Câu 3: Ở thuộc một đk về nhiệt độ và áp suất, số mol bất cứ chất khí như thế nào cũng hoàn toàn có thể tích:
A. Bởi nhau
B. 22 lít
C. 22,4 lít
D. 24 lít
Câu 4: Hợp hóa học là các chất tạo nên:
A. Từ 1 chất duuy nhất
B. Xuất phát điểm từ một nguyên tố hóa học
C. Từ khá nhiều chất không giống nhau
D. Từ hơn một nguyên tố hóa học
Câu 5: Trong cách làm hóa học tập của hidro sunfat H2S cùng khí sunfurơ SO2, hóa trị của sulfur lần lượt là:
A. I cùng II
B. II và IV
C. IV cùng II
D. Số đông là II
Câu 6: dãy nguyên tố chất hóa học nào dưới đây đều là kim loại?
A. Fe, Cu, Al
B. Fe, S, Cu
C. Fe, C, Al
D. Fe, Cu, H
II. TỰ LUẬN
Câu 1: chọn hệ số thích hợp để cân nặng bằng những phản ứng háo học sau:
Na + Cl2 −to→ Na
Cl
SO2 + O2 −to→ SO3
Fe + HCl → Fe
Cl2 + H2
Al(OH)3 −to→ Al2O3 + H2O
Câu 2: Tính số mol trong những hợp chất sau:
8 gam đồng oxit (Cu
O).
300 gam fe (III) sunfat (Fe2(SO4)3).
Ở điều kiện tiêu chuẩn, hãy tính thể tích của:
2 mol khí hidro.
16 gam khí oxi.
Cho biết nguyên tử khối của một trong những nguyên tố hóa học:
S=32, O=16, Cu=64, Fe=56.
Câu 3: Áp dụng cách làm tính tỉ khối, hãy tính:
Tỉ khối của khí oxi (O2) đối với khí hidro (H2).
Khối lượng mol khí A có tỉ khối đối với không khí là 2,207.
Câu 4: Đốt cháy 24 gam magie (Mg) với oxi (O2) trong không khí thu được 40 gam magie oxit (Mg
O). Bội phản ứng hóa học tất cả phương trinh chữ như sau:
Magie + oxi → magie oxit
Lập phương trình hóa học và viết phương pháp về cân nặng của bội phản ứng xảy ra.
Tính cân nặng khí oxi sẽ phản ứng
Đáp án và gợi ý giải
I. TRẮC NGHIỆM
Câu 1: lựa chọn B
Hướng dẫn: +) Fe
O : a x 1 = II x 1 → a = II (loại)
+) Fe2O3 : b x 2 = II x 3 → b = III (nhận)
+) Fe3O4 : c x 3 = II x 4 → c = 8/3 (loại)
Câu 2: lựa chọn D
Hướng dẫn: quy trình biễn đổi chất này thành chất khác gọi là hiện tượng kỳ lạ hóa học.
Câu 3: chọn A
Câu 4: chọn D
Hướng dẫn: Hợp hóa học là hầu hết chất làm cho từ hai nguyên tố hóa học trở lên.
Câu 5: chọn B
Hướng dẫn: +) vào H2S: I x 2 = a x 1 → a = II
+) SO2: b x 1 = II x 2 → b = IV
Câu 6: chọn A
II. TỰ LUẬN
Câu 1: cân bằng các phản ứng hóa học:
2Na + Cl2 −to→ 2Na
Cl
2SO2 + O2 −to→ 2SO3
Fe + 2HCl → Fe
Cl2 + H2↑
2Al(OH)3 −to→ Al2O3 + 3H2O
Câu 2: Tính số mol trong những lượng chất:
8 gam đồng oxit: n = m/M= 8/80 = 0,1 (mol)
300 gam Fe2(SO4)3: n = m/M= 300/400 = 0,75 (mol)
2 mol khí hidro: V = n.22,4 = 2.22,4 = 44,8 (lít)
16 gam khí oxi: n = m : M = 16 : 32 = 0,5 (mol)
V = n.22,4 = 0,5.22,4 = 11,2 (lít)
Câu 3: Áp dụng cách làm tính tỉ khối, ta có:
Tỉ khối của khí oxi (O2) so với khí hidro (H2):
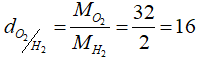
Khối lượng mol khí A gồm tỉ khối với bầu không khí là 2,207:
d
A/kk = MA/29 → MA = d.29 = 2,207.29 = 64 (gam)
Câu 4:
Lập phương trình hóa học cùng viết phương pháp về trọng lượng của các chất trong bội nghịch ứng: 2Mg + O2 → 2Mg
O
m
Mg+ m
O2= m
Mg
O
Khối lượng oxi phản ứng: m
O2= m
Mg
O- m
Mg= 40 – 24 = 16 (gam)

Phòng giáo dục và Đào tạo thành .....
Đề thi 45 phút học tập kì 1
Môn: chất hóa học lớp 8
Thời gian làm cho bài: 45 phút
(Đề 2)
I. TRẮC NGHIỆM
Hãy khhoanh tròn một trong số chữ A, B, C, D trước phương pháp chọn đúng.
Câu 1: nên lựa chọn câu phát biểu đúng.
A. Nguên tử là các hạt vô cùng bé dại gồm proton có điện tích dương và các electron mang điện tích âm.
B. Nguyên tử là đầy đủ hạt cực kì nhỏ, trung hòa về điện. Nguyên tử bao gồm hạt nhân mang điện tích dương với vỏ nguyên tử tạo nên bởi những electron sở hữu điện tích âm.
C. Phân tử nhân nguyên tử gồm các hạt proton, nowtron, electron.
D. Trong mỗi nguyên tử số proton thông qua số electron cộng với số nowtron.
Câu 2: cho các chất có công thức hóa học như sau:
1. O22. O33. CO24. Fe2O35. SO26. N27. H2O
Nhóm chỉ gồm những hợp hóa học là:
A. 1, 3, 5, 7
B. 2, 4, 6, 5
C. 2, 3, 5, 6
D. 3, 4, 5, 7
Câu 3: Một bình chứa các thành phần hỗn hợp khí X tất cả 1,12 lít khí oxi với 2,24 lít khí cacbon đioxit ở đktc. Tổng số mol những khí trong hỗn hợp khí X là:
A. 0,25
B. 0,5
C. 0,15
D. 0,20
Câu 4: công thức hóa học hợp hóa học của nguyên tố X với team SO4 bao gồm hóa trị II là X2(SO4)3. Bí quyết hóa học hợp hóa học của thành phần Y với hidro là H3Y.
Công thức chất hóa học hợp hóa học của nguyên tố X cùng nguyên tố Y là:
A. XY2
B. XY3
C. XY
D. X2Y3
Câu 5: Đốt cháy hoàn toàn 12,8 gam đồng (Cu) vào bình chứa oxi (O2) thu được 16 gam đồng (II) oxit (Cu
O). Trọng lượng oxi đang tham gia bội nghịch ứng là:
A. 6,4 gam
B. 4,8 gam
C. 3,2 gam
D. 1,67 gam
Câu 6: trọng lượng của 0,5 mol Mg cùng 0,3 mol CO2 tương xứng là:
A. 10 gam Mg; 12 gam CO2
B. 13 gam Mg; 15 gam CO2
C. 12 gam Mg; 13,2 gam CO2
D. 14 gam Mg; 14,5 gam CO2
(Cho Mg = 24; O = 16; C = 12).
Câu 7: Hãy điền các hệ số vào trước các công thức hóa học của những chất phù hợp để được các phương trình hóa học đúng.
___Al + ___H2SO4 → Al2(SO4)3 + ___H2
A. 2, 3, 1, 3
B. 3, 2, 1, 3
C. 2, 2, 1, 3
D. 2, 3, 3, 1
Câu 8: Thể tích các thành phần hỗn hợp khí tất cả 0,5 mol CO2 với 0,2 mol O2 ở đk tiêu chuẩn chỉnh là:
A. 11,2 lít
B. 22,4 lít
C. 4,48 lít
D. 15,68 lít
II. TỰ LUẬN
Câu 9:
1)Tính cân nặng của các thành phần hỗn hợp khí ngơi nghỉ đktc bao gồm 2,24 lít SO2 cùng 3,36 lít O2.
2)Tính thể tích sống đktc của một các thành phần hỗn hợp khí bao gồm 4,4 gam CO2 và 3,2 gam O2.
3)Tính số mol đựng trong 3.1023 phân tử nước.
Câu 10: phản nghịch ứng hóa học xảy ra khi rượu cồn cháy (đèn đụng trong chống thí nghiệm) là
Rượu etylic (C2H5OH) + oxi cacbonic (CO2) + nước
1)Hãy lập phương trình chất hóa học của phản ứng.
2)Cho biết tỉ lệ số phân tử của các chất trong phản ứng hóa học.
3)Tính tỉ lệ về trọng lượng giữa những chất trong làm phản ứng hóa học.
4)Tính thể tích khí oxi cần thiết để đốt cháy hết 4,6 gam rượu etylic cùng thể tích khí cacbonic sinh sản thành ở đk tiêu chuẩn.
Đáp án và lí giải giải
I. TRẮC NGHIỆM
Câu 1: lựa chọn B
Câu 2: lựa chọn D
Câu 3: chọn C
Hướng dẫn: n
O2= 1,12/22,4 = 0,05 (mol)
n
CO2= 2,24/22,4 = 0,1 (mol)
nhh
X = n
O2+ n
CO2= 0,05 + 0,1 = 0,15 (mol)
Câu 4: chọn C
Hướng dẫn: * X2(SO4)3 : a x 2 = II x 3 → a = III
* H3Y : I x 3 = b x 1 → b = III → CTHH: XY
Câu 5: lựa chọn C
Hướng dẫn: Áp dụng ĐLBTKL, ta có:
m
Cu+ m
O2= m
Cu
O→ m
O2= m
Cu
O- m
Cu= 16 – 12,8 = 3,2 (gam)
Câu 6: chọn C
Hướng dẫn: +) m
Mg = 0,5.24 = 12 (gam)
+) m
CO2= 0,3.44 = 13,2 (gam)
Câu 7: hướng dẫn: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑. Lựa chọn A
Câu 8: lựa chọn D
Hướng dẫn: Vhh = (0,5+0,2) x 22,4 = 15,68 (lít)
II. TỰ LUẬN
Câu 9:
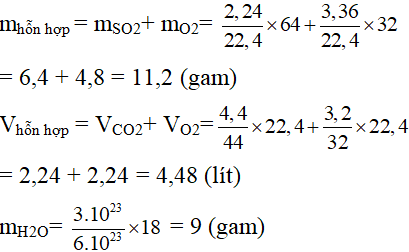
Câu 10:
C2H5OH + 3O2 −to→ 2CO2 + 3H2O(1)
Tỉ lệ số phân tử C2H5OH: số phân tử O2: số phân tử CO2: số phân tử H2O = 1 : 3 : 2 : 3
m
C2H5OH ∶ m
O2 ∶ m
CO: m
H2O = 46 : (3x32) : (2x44) : (3x18)
= 46 : 96 : 88 : 54
Ta tất cả : n
C2H5OH= 4,6/46 = 0,1 (mol)
Từ (1) → n
CO2=0,2 (mol) → VCO2= 0,2.22,4 = 4,48 (lít)
Từ (1) → n
O2= 0,3 (mol) → VO2= 0,3.22,3 = 6,72 (lít)
Phòng giáo dục và Đào sinh sản .....
Đề thi 45 phút học kì 1
Môn: chất hóa học lớp 8
Thời gian có tác dụng bài: 45 phút
(Đề 3)
I. TRẮC NGHIỆM
Khoanh tròn vão chữ A hoặc B, C, D trước phương pháp chọn đúng.
Câu 1: Cho phần lớn oxit sau: SO2, K2O, Ca
O, N2O5, P2O5, Ba
O. Dãy gồm những oxit tính năng với H2O, tạo thành bazơ là:
A. SO2, Ca
O, K2O
B. K2O, N2O5, P2O5
C. Ca
O, K2O, Ba
O
D. K2O, SO2, P2O5
Câu 2: phần lớn oxit sau: Ca
O, SO2, Fe2O3, Na2O, CO2, P2O5. Dãy tất cả nhưungx oxit tác dụng với nước tạo ra axit là:
A. Ca
O, SO2, Fe2O3
B. SO2, Na2O, Ca
O
C. SO2, CO2, P2O5
D. CO2, Fe2O3, P2O5
Câu 3: cho các bazơ sau: Li
OH, Na
OH, KOH, Ca(OH)2, Mg(OH)2, Al(OH)3, Fe(OH)3. Hàng bazơ chảy trong nước tạo nên thành hỗn hợp kiềm là:
A. Ca(OH)2, Li
OH, Cu(OH)2, Mg(OH)2
B. Ca(OH)2, KOH, Li
OH, Na
OH
C. KOH, Li
OH, Na
OH, Al(OH)3
D. Al(OH)3, Na
OH, Mg(OH)2, KOH
Câu 4: có những chất rắn sau: Fe
O, P2O5, Ba(OH)2, Na
NO3. Thuốc demo được lựa chọn để phân biệt những chất bên trên là:
A. H2SO4, giấy quỳ tím.
B. H2O, giấy quỳ tím.
C. Hỗn hợp Na
OH, giấy quỳ tím.
D. Dung dịch HCl, giấy quỳ tím.
Câu 5: Độ rã của một chất trong nước làm việc nhiệt độ khẳng định là:
A. Số gam hóa học tan tan trong 100 gam nước.
B. Số gam hóa học tan tung trong 100 gam dung môi.
C. Số gam chất tan tan trong 1 lít nước để tạo thành hỗn hợp bão hòa.
D. Số gam hóa học tan rã được trong 100 gam nước để chế tạo ra thành dung dịch bão hòa.
Câu 6: dãy hợp hóa học gồm những chất thuộc một số loại muối là:
A. Na2O, Cu
SO4, KOH
B. Ca
CO3, Mg
O, Al2(SO4)3
C. Ca
CO3, Ca
Cl2, Fe
SO4
D. H2SO4, Cu
SO4, Ca(OH)2
II. TỰ LUẬN
Câu 7: Viết phương trình hóa học biểu diễn dãy đổi khác sau:
a)S → SO2 → H2SO3
b)Ca → Ca
O → Ca(OH)2
Câu 8: Ở 20ºC, hài hòa 60 gam KNO3 vào 190 gam H2O thì thu được dung dịch bão hòa. Hãy tính độ chảy của KNO3, ở ánh nắng mặt trời đó.
Câu 9: Tính khối lượng khí oxi cần dùng làm đốt cháy trọn vẹn 1 tấn than (chứa 95% cacbon). Rất nhiều tạp chất sót lại không cháy được.
(Biết H=1, C=12, O=16, Fe=56, K=39, N=14).
Đáp án và chỉ dẫn giải
I. TRẮC NGHIỆM
Câu 1: lựa chọn C
Chỉ gồm oxit sắt kẽm kim loại (K2O, Ba
O, Ca
O) tính năng với nước tạo ra bazơ tương ứng.
Câu 2: chọn C
Chỉ gồm có oxit axit mới công dụng với nước tạo nên dung dịch axit tương ứng.
Câu 3: lựa chọn B
Chỉ tất cả 5 bazơ tan trong nước tạo nên dung dịch bazơ là: Li
OH, Na
OH, KOH, Ba(OH)2, Ca(OH)2.
Câu 4: lựa chọn B
Cho nước lần lượt vào những chất rắn. Hóa học rắn ko tan là Fe
O, các chất còn sót lại tan. P2O5 + 3H2O 2H3PO4
Nhúng quỳ tím vào các dung dịch thu được:
+) Dung dịch có tác dụng quỳ tím hóa đỏ là thành phầm của P2O5
+) Dung dịch làm quỳ tím hóa xanh là Ba(OH)2
+) Dung dịch không có hiện tượng gì là Na
NO3
Câu 5: lựa chọn D
Câu 6: chọn C
Muối là hợp hóa học hóa học bao gồm một hay những nguyên tử kim loại link với một hay nhiều gốc axit.
II. TỰ LUẬN
Câu 7:
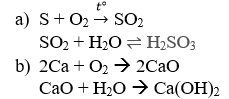
Câu 8: Cứ 190 gam H2O tổ hợp hết 60 gam KNO3 chế tạo ra dung dịch bão hòa
100 gam H2O hài hòa hết x gam KNO3.
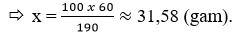
Câu 9: cân nặng C có trong 1 tấn than là:
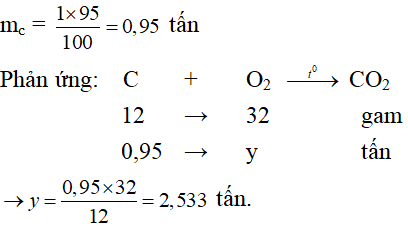

Phòng giáo dục và đào tạo và Đào chế tác .....
Đề thi 45 phút học tập kì 1
Môn: hóa học lớp 8
Thời gian làm cho bài: 45 phút
(Đề 4)
I. TRẮC NGHIỆM
Hãy khoanh tròn một trong các chữ dòng (A, B, C, D) đứng trước câu vấn đáp đúng nhất.
Câu 1: phương thức chứng cất được dung để tách một các thành phần hỗn hợp gồm:
A. Nước với muối hạt ăn
B. Nước với rượu
C. Mèo với đường
D. Bột sắt với lưu lại huỳnh
Câu 2: cho các công thức hóa học của một số chất như sau: oxi O2, bội nghĩa clorua Ag
Cl, magie oxit Mg
O, sắt kẽm kim loại đồng Cu, kali nitrat KNO3, natri hidroxit Na
OH.
Trong các chất trên gồm mấy solo chất, mấy vừa lòng chất?
A. 3 đối kháng chất và 3 phù hợp chất
B. 1 1-1 chất và 5 hợp chất
C. 4 đối kháng chất và 2 thích hợp chất
D. 2 đơn chất cùng 4 phù hợp chất
Câu 3: nhì nguyên tử không giống nhau, hy vọng có cùng kí hiệu hóa học phải gồm tính chất:
A. Cùng số elctron vào nhân
B. Cùng số nowtron vào nhân
C. Cùng số proton vào nhân
D. Cùng khối lượng
Câu 4: Từ bí quyết hóa học tập K2CO3 cho biết ý làm sao đúng?
Hợp hóa học trên bởi 3 solo chất K, C, O tạo nên nên.
Hợp hóa học trên bởi 3 nhân tố K, C, O tạo ra nên.
Hợp chất trên bao gồm phân tử khối 138 đv
C (K=39, c=12, O=16).
Hơp hóa học trên là hỗn hợp 3 chất kali, cacbon, oxi.
A. 1, 2, 3
B. 2, 3, 4
C. 1, 4
D. 2, 3
Câu 5: Theo hóa trị của sắt trong Fe2O3, nên chọn lựa công thức chất hóa học đúng của đúng theo chất có Fe liên kết với team nguyên tử SO4(II).
A. Fe2(SO4)3
B. Fe
SO4
C. Fe3(SO4)2
D. Fe2SO4
Câu 6: buộc phải lấy bao nhiêu gam sắt kẽm kim loại sắt để sở hữu số nguyên tử các gấp gấp đôi số nguyên tử bao gồm trong 8 gam lưu giữ huỳnh?
A. 29 gam
B. 28 gam
C. 28,5 gam
D. 56 gam
II. TỰ LUẬN
Câu 7:
Tính hóa trị của nguyên tố p trong hợp hóa học P2O5.Lập cách làm hóa học cùng tính cân nặng mol của phù hợp chất bao gồm Al(III) lien kết với đội SO4(II). (Al=27, S=32, O=16)
Câu 8: mang lại sơ đồ những phản ứng sau:
Al + O2 −to→ Al2O3
P2O5 + H2O H3PO4
KCl
O3 −to→ KCl + O2
Na + H2O → Na
OH + H2
H2 + Fe2O3 −to→ sắt + H2O
Mg + HCl → Mg
Cl2 + H2
Hãy chọn hệ số và viết thành phương trình hóa học.
Câu 9: Tìm cân nặng của 1,8.1023 phân tử CO2 và cho biết thêm lượng chất trên chiếm phần thể tích bao nhiêu ml (đo sinh hoạt đktc)? (C=12, O=16)
Đáp án và trả lời giải
I. TRẮC NGHIỆM
Câu 1: lựa chọn B
Hướng dẫn: phương pháp chưng đựng dung để tách bóc hai hóa học lỏng thoát ra khỏi nhau (nhiệt độ sôi khác nhau nhiều).
Câu 2: chọn D
Hướng dẫn: +) Đơn chất là rất nhiều chất được làm cho từ 1 thành phần hóa học.
+) Hợp chất là phần nhiều chất được tạo cho từ 2 nguyên tố chất hóa học trở lên.
Câu 3: chọn C
Câu 4: chọn D
Câu 5: lựa chọn A
Hướng dẫn: +) từ bỏ Fe2O3 → Fe có hóa trị III.
+) Fex(SO4)y. Áp dụng phép tắc hóa trị, ta có:
III.x = II.y → x/y=II/III=2/3
→ CTHH: Fe2(SO4)3.
Câu 6: chọn B
Hướng dẫn: Ta có: n
S = 8/32 = 0,25 (mol)
Số nguyên tử sắt = 2 x số nguyên tử S
n
Fe = 2 x n
S = 2 x 0,25 = 0,5 (mol)
MFe = 0,5 x 56 = 28 (gam)
II. TỰ LUẬN
Câu 7:
Gọi t là hóa trị của p trong P2O5
Theo nguyên tắc hóa trị: 2 x t = 5 x II → t = V
Alx(SO4)y
Theo phép tắc hóa trị: x.III = y.II → x/y = II/III= 2/3
x=2, y=3 → CTHH: Al2(SO4)3
M = 27.2 + (32 + 16.4).3 = 342 (gam)
Câu 8:
4Al + 3O2 −to→ 2Al2O3
P2O5 + 3H2O → 2H3PO4
2KCl
O3 −to→ 2KCl + 3O2 ↑
Na + H2O → Na
OH + 1/2 H2 ↑
3H2 + Fe2O3 −to→ 2Fe + 3H2O
Mg + 2HCl → Mg
Cl2 + H2 ↑
Câu 9: Ta có: n
CO2= (1,8.1023)/(6.1023) = 0,3 (mol)
m
CO2=0,3 x 44=13,2 (gam)
Và VCO2= 0,3 x 22,4 = 6,72 (lit) = 6720 (ml)

Phòng giáo dục đào tạo và Đào tạo nên .....
Đề thi 45 phút học tập kì 1
Môn: hóa học lớp 8
Thời gian có tác dụng bài: 45 phút
(Đề 5)
I. TRẮC NGHIỆM
Học sinh nên chọn lựa và khoanh tròn câu vấn đáp đúng nhất mang đến các thắc mắc sau:Câu 1: Ở trạng thái bình thường, nguyên tử trung hòa - nhân chính về điện vì:
A. Số p = số n
B. Số n = số e
C. Số e = số p
D. Toàn bộ đều đúng
Câu 2: công thức hóa học nào dưới đây viết đúng?
A. Na
O2
B. CO3
C. Ag
O
D. Al2O3
Câu 3: Khi thổi hơi thở nhẹ vào ống nghiệm đựng nước vôi trong, hiện tượng lạ quan tiếp giáp được là:
A. Sủi bọt khí
B. Nước vôi trong bị đục
C. Nước vôi trong vẫn vào suốt
D. Nước vôi trong gửi sang màu hồng
Câu 4: Phương trình hóa học dung để trình diễn ngắn gọn:
A. Một phân tử
B. Kí hiệu hóa học
C. Công thức hóa học
D. Phản bội ứng hóa học
Câu 5: Hai chất khí khác biệt có cùng 1 mol, được đo ở cùng điều kiên ánh nắng mặt trời và áp suất tương đồng thì thể tích của hai hóa học khí này như thế nào?
A. Bởi nhau
B. Cân nhau và bởi 22,4 lít
C. Khác nhau
D. Không thể xác minh được
Câu 6: cách làm hóa học của một chất cho ta biết:
A. Phân tử khối của chất.
B. Những nguyên tố kết cấu nên chất.
C. Số nguyên tử của mỗi nguyên tố gồm trong một phân tử chất.
D. Toàn bộ đều đúng.
Câu 7: Phân tử khối của can xi cacbonat Ca
CO3 cùng sắt(III) sunfat Fe2(SO4)3 theo thứ tự là:
A. 197 và 342
B. 100 cùng 400
C. 197 với 234
D. 400 cùng 100
II. PHẦN TỰ LUẬN
Câu 1: Chọn rất nhiều từ hoặc các từ phù hợp điền vào địa điểm trống:
_____ là quá trình đổi khác chất này thành chất khác. Chất biến đổi trong phản nghịch ứng call là _____, còn _____ new sinh ra hotline là _____. Vào úa trình phản bội ứng, lượng hóa học _____ bớt dần, còn lượng chất_____ tang dần.
Câu 2: Tính trọng lượng của:
0,15 mol Cu
SO4 (Cho Cu=64, S=32, O=16)
5,6 lít khí CO2 (đktc) (Cho C=12, O=16)
Câu 3: Hãy lập những phương trình hóa học sau đây:
Fe + Cl2 −to→ Fe
Cl3
P2O5 + H2O → H3PO4
CO2 + KOH → K2CO3 + H2O
Al2O3 + HCl → Al
Cl3 + H2O
Câu 4: Hòa tan hoàn toàn 6,5 gam kẽm vào dung dịch axit clohidric HCl bao gồm chứa 7,3 gam HCl (vừa đủ). Sau bội phản ứng thu được hỗn hợp muối kẽm clorua cùng 0,2 gam khí hidro.
Lập công thức hóa học tập của muối hạt kẽm clorua. Biết kẽm clorua vì chưng hai nhân tố là Zn cùng Cl tạo nên ra.
Tính cân nặng muối kẽm clorua tạo nên thành.
Đáp án và chỉ dẫn giải
I. TRẮC NGHIỆM
Câu 1: lựa chọn C
Hướng dẫn: Số proton có điện dương với số electron có điện âm.
Câu 2: lựa chọn D
Hướng dẫn: Áp dụng phép tắc hóa trị nhằm suy ra phương pháp đúng.
Câu 3: lựa chọn B
Hướng dẫn: Trong khá thở bao gồm khí CO2 đề xuất làm đục nước vôi vào theo làm phản ứng:
CO2 + Ca(OH)2 → Ca
CO3↓ + H2O
Câu 4: lựa chọn D
Câu 5: lựa chọn A
Hướng dẫn: những khí khác biệt được nghỉ ngơi cùng điều kiện về: ánh sáng và áp suất thì tất cả cùng số mol => thể tích bằng nhau.
Câu 6: lựa chọn D
Câu 7: chọn B
Hướng dẫn: +) Ca
CO3 : 40 + 12 + 16 x 3 = 100 đv
C
+) Fe2(SO4)3 : 56 x 2 + (32 + 16 x 4) x 3 = 400 đv
C
II. TỰ LUẬN
Câu 1:
Phản ứng hóa học là quá trình biến hóa chất này thành chất khác. Chất đổi khác trong làm phản ứng điện thoại tư vấn là chất phản ứng, còn chất bắt đầu sinh ra gọi là sản phẩm. Trong vượt trinh phản ứng, lượng hóa học phản ứng giảm dần, còn lượng chất sản phẩm tang dần.
Bộ 13 Đề thi học kì 1 chất hóa học lớp 8 bao gồm đáp án chi tiết giúp học sinh ôn luyện nhằm đạt điểm cao trong bài xích thi hóa học 8 học kì 1. Mời các bạn cùng đón xem:
Đề thi học kì 1 Hoá học lớp 8 năm 2022 - 2023 bao gồm đáp án
Phòng giáo dục đào tạo và Đào tạo ra .....
Đề khảo sát chất lượng Học kì 1
Năm học tập 2022 - 2023
Môn: Hóa học tập 8
Thời gian làm cho bài: 45 phút
Đề thi học kì 1 Hoá học tập lớp 8 năm 2022 - 2023 có đáp án Đề số 1
(Cho C=12, O=16, H=1, Na=23, K=39, Mg =24, Ca=40, P=31, Cl =35,5, Fe=56, Al=27, N=14, S=32, Cu=64)
I - TRẮC NGHIỆM (6 điểm)
Câu 1. Trong những mệnh đề sau, mệnh đề nào đúng?
A. Tổng sản phẩm các chất bằng tổng hóa học tham gia.
B. Trong một phản ứng, tổng số phân tử chất tham gia bởi tổng số phân tử hóa học tạo thành.
C. Vào một phản ứng hóa học, tổng cân nặng của các thành phầm bằng tổng trọng lượng của các chất phản ứng.
D. Không có mệnh đề làm sao đúng.
Câu 2. Trong các định nghĩa về nguyên tử sau đây, khái niệm nào là đúng?
A. Nguyên tử là hạt vô cùng bé dại và th-nc về điện.
B. Nguyên tử là hạt khôn xiết nhỏ, bị phân chia trong số phản ứng hóa học.
C. Nguyên tử là phân tử vô cùng bé dại và th-nc về điện, bao gồm hạt nhân có điện tích dương và vỏ tạo vị electron với điện tích âm.
D. Toàn bộ đều đúng.
Câu 3. Dãy phương pháp hóa học tập đúng là
A. Ca
O2, Na2O, H2SO4, Fe(OH)3.
B. Na2O, Na
Cl, Ca
O, H2SO4.
C. Na2O, P5O2, H2SO4, Na
Cl.
D Na2O, HSO4, Fe(OH)3, Ca
O2.
Câu 4. Cho hợp chất Ax
By, trong số ấy A có hóa trị a, B gồm hóa trị b. Công thức quy tắc hóa trị là
A. A.x = b.y
B. A.b = x.y
C. A.y = b.x
D. A.b.x = b.y.a
Câu 5. các công thức hóa học biểu diễn nhóm solo chất là
A. Fe, CO2 , O2.
B. KCl , HCl , Mg
C. HCl, Al2O3, CO2.
D. Mãng cầu , H2 , Ag
Câu 6. Cho những chất sau: Cl2; H2SO4; Cu(NO3)2. Phân tử khối của các chất theo lần lượt là
A. 71; 98; 188.
B. 70; 98; 18
C. 71; 188; 98.
D. 71; 180; 98
Câu 7. Cho biết cân nặng của cacbon bằng 3kg, cân nặng của CO2 bằng 11kg. Cân nặng của O2 tham gia phản ứng là
A. 9 kg
B. 8 kilogam
C. 7,9 kg
D. 14 kg
Câu 8. Oxit nào giàu oxi tuyệt nhất (hàm lượng % oxi lớp nhất)?
A. Al2O3.
B. N2O3.
C. P2O5.
D. Fe3O4.
Câu 9. Các nguyên tử của cùng một nguyên tố hóa học gồm cùng:
A. Số proton trong hạt nhân.
B. Số nơtron.
C. Số điện tử trong phân tử nhân.
D. Khối lượng.
Câu 10. Hiện tượng làm sao sau đó là hiện tượng hóa học?
A. Nhôm nung nóng chảy nhằm đúc xoong, nồi...
B. Than đề xuất đập vừa nhỏ tuổi trước khi gửi vào phòng bếp lò.
C. Hễ để vào lọ không kín bị bay hơi.
D. Trứng nhằm lâu ngày có khả năng sẽ bị thối.
Câu 11. Trong phương pháp hóa học tập của hiđro sunfua (H2S) cùng khí sunfurơ (SO2), hóa trị của diêm sinh lần lượt là:
A. I và II.
B. II cùng IV.
C. II và VI.
D. IV và VI.
Câu 12. dãy nào gồm các chất là đúng theo chất?
A. Ca
O; Cl2; CO; CO2
B. Cl2; N2; Mg; Al
C. CO2; Na
Cl; Ca
CO3; H2O
D. Cl2; CO2; Ca(OH)2; Ca
SO4
Câu 13. Hóa trị của nitơ vào hợp hóa học đi nitơ oxit (N2O) là?
A. I
B. II
C. IV
D. V
Câu 14. Magie oxit có công thức chất hóa học là Mg
O. Phương pháp hóa học tập của magie cùng với clo hóa trị I là?
A. Mg
Cl3
B. Cl3Mg
C. Mg
Cl2
D. Mg
Cl
Câu 15. hiện nay tượng biến hóa nào dưới đó là hiện tượng hóa học?
A. đèn điện phát sáng, kèm theo tỏa nhiệt.
B. Hòa tan đường vào nước để được nước đường.
C. Đung lạnh đường, đường chảy rồi thay đổi màu đen, nặng mùi hắc.
D. Trời nắng, nước bốc hơi ra đời mây.
Câu 16. cân nặng của 0,1 mol sắt kẽm kim loại sắt là?
A. 0,28 gam
B. 5,6 gam
C. 2,8 gam
D. 0,56 gam
Câu 17. Cho phương trình hóa học sau: C + O2 → CO2. Tỉ lệ số mol phân tử của C phản nghịch ứng với số mol phân tử oxi là?
A. 1 : 2
B. 1 : 4
C. 2 : 1
D. 1 : 1
Câu 18: “Chất biến hóa trong làm phản ứng là.........., còn chất new sinh ra hotline là.........”
A. Hóa học xúc tác – sản phẩm
B. Chất tham gia – chất phản ứng
C. Hóa học phản ứng – sản phẩm
D. Hóa học xúc tác – hóa học tạo thành
II- TỰ LUẬN
Câu 1 (1,0 điểm): Lập phương trình hoá học của những phản ứng sau:
a) K + H2O KOH + H2
b) Al2O3 + H2SO4 Al2(SO4)3 + H2O
Câu 2 (3,0 điểm): cho 4,8 gam magie chức năng với dung dịch axit clohiđric (HCl) dư, thu được dung dich magie clorua Mg
Cl2 với khí H2.
a) Viết phương trình hóa học xảy ra.
b) Tính cân nặng HCl đề xuất vừa đủ mang đến phản ứng trên.
c) Tính thể tích khí hiđro hiện ra (ở đktc) .
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI ĐỀ 1
I-TRẮC NGHIỆM
1. C | 2. C | 3. B | 4. A | 5. D | 6. A | 7. B | 8. B | 9. A |
10. D | 11. B | 12. C | 13. A | 14. C | 15. C | 16. B | 17. D | 18. C |
Câu 1: Định công cụ bảo toàn trọng lượng được tuyên bố như sau:
“Trong một phản bội ứng hóa học, tổng cân nặng của những chất thành phầm bằng tổng cân nặng của các chất tham gia phản ứng”.
→ Đáp án C
Câu 2: Nguyên tử là phân tử vô cùng bé dại và trung hòa - nhân chính về điện. Nguyên tử bao gồm hạt nhân mang điện tích dương cùng vỏ tạo do một hay những electron với điện tích âm.
→ Đáp án C
Câu 3: Công thức chất hóa học viết đúng gồm: Na2O, H2SO4, Fe(OH)3, Na
Cl, Ca
O.
→ Đáp án B
Câu 4: Theo quy tắc hóa trị ta có: a.x = b.y
→ Đáp án A
Câu 5: Đơn hóa học là hóa học chỉ tạo bởi một yếu tố hóa học.
→ Đáp án D
Câu 6: Phân tử khối của Cl2 là 35,5.2 = 71
Phân tử khối của H2SO4 là 1.2 + 32 + 16.4 = 98
Phân tử khối của Cu(NO3)2 là 64 + (14 + 16.3).2 = 188
→ Đáp án A
Câu 7: Phương trình hóa học:
C + O2 →to
CO2
Áp dụng định phép tắc bảo toàn khối lượng ta có:
m
C+m
O2=m
CO2→m
O2=m
CO2−m
C= 11 – 3 = 8 kg
→ Đáp án B
Câu 8: Hàm lượng % O trong oxit là:
%O (Al2O3)=16.327.2+16.3.100%=47,06%
%O (N2O3)=16.314.2+16.3.100%=63,16%
%O (P2O5)=16.531.2+16.5.100%=56,34%
%O (Fe3O4)=16.456.3+16.4.100%=27,99%
→ Đáp án B
Câu 9: Các nguyên tử của cùng một nguyên tố hóa học tất cả cùng số proton trong hạt nhân.
→ Đáp án A
Câu 10: Hiện tượng chất hóa học là hiện tượng lạ mà chất biến hóa tạo ra hóa học khác.
→ Đáp án D
Câu 11: Hóa trị của S trong H2S là II
Hóa trị của S vào SO2 là IV.
→ Đáp án B
Câu 12: Hợp chất là hóa học tạo vì từ nhị nguyên tố chất hóa học trở nên.
→ Đáp án C
Câu 13: Gọi hóa trị của N trong N2O là x.
Theo phép tắc hóa trị, ta có: 2.x = 1.II → x = I.
→ Đáp án A
Câu 14: Gọi hóa trị của Mg vào hợp chất là x.
Xét bí quyết Mg
O, theo quy tắc hóa trị, ta có:
1.x = 1.II → x = II.
Gọi bí quyết hóa học tập của Mg cùng với clo có dạng Mga
Clb.
Ta có: ab=III=12→ a = 1; b = 2
→ Công thức nên tìm là Mg
Cl2.
→ Đáp án C
Câu 15: Hiện tượng hóa học là hiện tượng kỳ lạ mà chất biến hóa tạo ra hóa học khác.
A, B, D là hiện tượng lạ vật lý.
C là hiện tượng lạ hóa học vì chưng đường đã chuyển thành chất khác.
→ Đáp án C
Câu 16: m
Fe = 0,1.56 = 5,6 gam
→ Đáp án B
Câu 17: Phương trình hóa học: C + O2 →to
CO2↑
→ tỉ trọng số mol phân tử của C phản bội ứng cùng với số mol phân tử oxi là tỉ lệ thành phần trong phương trình và bằng 1 : 1.
→ Đáp án D
Câu 18: Chất thay đổi trong làm phản ứng là chất bội nghịch ứng (chất tham gia), còn chất mới sinh ra call là sản phẩm (chất chế tạo thành).
→ Đáp án C
II- TỰ LUẬN
Câu 1:
a) 2K + 2H2O → 2KOH + H2↑
b) Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Câu 2:
a) Phương trình hóa học:
Mg + 2HCl → Mg
Cl2 + H2↑
b) Theo bài,n
Mg=4,824=0,2 mol
Theo phương trình, ta có: n
HCl=2n
Mg= 0,4 mol
Khối lượng HCl cần dùng toàn vẹn là: m
HCl = 0,4.36,5 = 14,6 gam
c) Theo phương trình, ta có:n
H2=n
Mg=0,2 mol
Thể tích khí hiđro hình thành là: VH2=0,2.22,4=4,48lít
Phòng giáo dục đào tạo và Đào chế tạo ra .....
Đề khảo sát unique Học kì 1
Năm học tập 2022 - 2023
Môn: Hóa học 8
Thời gian làm cho bài: 45 phút
Đề thi học tập kì 1 Hoá học lớp 8 năm 2022 - 2023 bao gồm đáp án Đề số 2
(Cho C=12, O=16, H=1, Mg=32, K=39, Mg =24, Ca=40, P=31, Cl =35,5, Zn=65, N=14, S=32)
I - TRẮC NGHIỆM (6 điểm)
Câu 1: Muốn thu khí NH3 vào bình thì thu bởi cách:
A. Đặt úp ngược bình.
B. Đặt đứng bình
C. Bí quyết nào cũng khá được
D. Đặt nghiêng bình
Câu 2: Tỉ khối của khí A so với khí nitơ (N2) là 1,675 .Vậy khối lượng mol của khí A tương đương:
A. 45g
B. 46g
C. 47g
D. 48g
Câu 3: Thành phần phần trăm theo trọng lượng của nguyên tố S vào hợp chất SO3 là:
A. 40%
B. 60%
C. 20%
D. 80%
Câu 4: “Chất đổi khác trong làm phản ứng là.........., còn chất bắt đầu sinh ra gọi là.........”
A. Chất xúc tác – sản phẩm
B. Chất tham gia – chất phản ứng
C. Chất phản ứng – sản phẩm
D. Chất xúc tác – hóa học tạo thành
Câu 5: Đun nóng đường, đường chảy lỏng. Đây là hiện tượng:
A. đồ gia dụng lý
B. Hóa học
C. Sinh học
D. Từ bỏ nhiên
Câu 6: Thể tích mol của chất khí là thể tích chiếm vày N….. Của khí đó. Từ phù hợp là:
A. Nguyên tử
B. Số mol
C. Khối lượng
D. Phân tử
Câu 7: Cho các khí sau: N2, H2, CO, SO2 khí nào nặng hơn không khí ?
A. Khí N2
B. Khí H2
C. Khí CO
D. Khí SO2.
Câu 8: Số mol của 0,56 gam khí nitơ là:
A. 0,01 mol
B. 0,02 mol
C. 0,025 mol
D. 0,1 mol
Câu 9: Cho phương trình: Cu + O2 Cu
O. Phương trình cân bằng đúng là:
A.2Cu + O2 →to
Cu
O
B. 2Cu + 2O2 →to4Cu
O
C. Cu + O2 →to2Cu
O
D. 2Cu + O2 →to2Cu
O
Câu 10: phát biểu như thế nào sau đây là đúng ?
A. Thủy tinh trong nóng tan thổi thành bình cầu là hiện tượng hóa học.
B. Bí quyết hóa học của sắt (III) với O (II) là Fe3O2.
C. Ở điều kiện tiêu chuẩn, 1 mol hóa học khí hoàn toàn có thể tích là 22,4 lít.
D. Nguyên tử thuộc loại gồm cùng số proton cùng số nơtron trong phân tử nhân.
Câu 11: Trong các phương trình sau, phương trình nào cân đối sai ?
A. 2Fe + 3Cl2 →to2Fe
Cl3
B. 2H2 + O2 →to2H2O
C. 2Al + 3O2 →to2Al2O3
D. Zn + 2HCl →to
Zn
Cl2 + H2
Câu 12: Cho sơ trang bị phản ứng sau: Al + Cu
O --> Al2O3 + Cu . Phương trình thăng bằng đúng là:
A. 2Al + 3Cu
O →to
Al2O3 + 3Cu
B. 2Al + 2Cu
O →to
Al2O3 + 3Cu
C. 2Al + 3Cu
O →to
Al2O3 + 2Cu
D.4 Al + Cu
O →to
Al2O3 + Cu
Câu 13: Tỉ khối của khí C đối với không khí là d
C/KK
A. O2.
B. N2.
C. CO2.
D. H2S.
Câu 14: 11 gam CO2 có thể tích là:
A. 6,5 lít
B. 44 lít
C. 56,6 lít
D. 5,6 lít
Câu 15: Số mol phân tử N2 gồm trong 280g nitơ là:
A. 28 mol
B. 10 mol
C. 11 mol
D. 12 mol
Câu 16: Khí oxi nặng hơn khí hiđro:
A. 4 lần
B. 16 lần
C. 32 lần
D. 8 lần
Câu 17. Số electron trong nguyên tử Al (có số proton =13) là:
A. 10
B. 11
C. 12
D. 13.
Câu 18. trọng lượng của 0,1 mol kim loại kẽm là?
A. 0,65 gam
B. 5,6 gam
C. 6,5 gam
D. 0,56 gam
II- TỰ LUẬN (4 điểm)
Câu 1 (1,5 điểm): Cân bằng những phương trình sau:
a) K + O2 →to
K2O
b) Na
OH + Fe2(SO4)3 →to
Fe(OH)3 + Na2SO4
c) Ba
Cl2 + Ag
NO3 →to
Ag
Cl + Ba(NO3)2
Câu 2 (2,5 điểm): Đốt cháy 18g kim loại magie Mg trong bầu không khí thu được 30g hợp hóa học magie oxit (Mg
O). Biết rằng Mg cháy là xẩy ra phản ứng cùng với khí oxi trong không khí.
a) Viết phương trình chất hóa học của làm phản ứng.
b) Tính cân nặng khí oxi vẫn phản ứng.
c) Tính thể tích hỗn hợp HCl 1M cần dùng để làm hòa tan hết hóa học rắn Mg
O làm việc trên.
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
I. TRẮC NGHIỆM
1. A | 2. C | 3. A | 4. C | 5. A | 6. D | 7. D | 8. B | 9. D |
10. C | 11. C | 12. A | 13. B | 14. D | 15. B | 16. B | 17. D | 18. C |
Câu 1: Khí NH3 tan những trong nước đề xuất không thu khí bằng cách thức đẩy nước nhưng mà thu khí bằng cách thức đẩy ko khí. Khí NH3 nhẹ hơn không khí đề xuất thu khí bằng phương pháp úp bình.
→ Đáp án A
Câu 2:
Ta có:d
A/N2=1,675→MA=28.1,675=46,9g≈47g
→ Đáp án C
Câu 3:
%S (SO2)=3232+16.3.100%=40%
→ Đáp án A
Câu 4:
Chất chuyển đổi trong phản ứng là chất bội phản ứng (chất tham gia), còn chất new sinh ra gọi là sản phẩm (chất tạo thành thành).
→ Đáp án C
Câu 5: Đun rét đường, đường chảy lỏng thì đấy là quá trình rét chảy.
→ Đây là hiện tượng vật lý.
→ Đáp án A
Câu 6:
Thể tích mol của hóa học khí là thể tích chiếm vị N phân tử của khí đó
→ Đáp án D
Câu 7: Các khí tất cả tỉ khối so với ko khí lớn hơn 1 thì nặng hơn không khí.
→ SO2 nặng hơn không khí.
→ Đáp án D
Câu 8:
Số mol khí N2 là:n
N2=0,5628=0,02 mol
→ Đáp án B
Câu 9:
2Cu + O2 →to2Cu
O
→ Đáp án D
Câu 10:
A. Sai vì là hiện tượng lạ vật lý.
B. Sai do công thức và đúng là Fe2O3.
C. đúng.
D. Nguyên tử thuộc loại gồm cùng số proton trong phân tử nhân.
→ Đáp án C
Câu 11:
C cân bằng sai.
Đúng: 4Al + 3O2 →to2Al2O3
→ Đáp án C
Câu 12:
Phương trình hóa học:
2Al + 3Cu
O →to
Al2O3 + 3Cu
→ Đáp án A
Câu 13:
Tỉ khối của khí C đối với không khí là d
C/KK
→ Khí C là N2.
→ Đáp án B
Câu 14:
Số mol khí CO2 là:n
CO2=1144=0,25 mol
Thể tích khí CO2 là: VCO2=0,25.22,4=5,6lít
→ Đáp án D
Câu 15:
Số mol phân tử N2 là28028=10 mol
→ Đáp án B
Câu 16:
d
O2/H2=MO2MH2=322=16
→ Khí oxi nặng hơn khí hiđro 16 lần.
→ Đáp án B
Câu 17:
Số electron trong nguyên tử = số proton = 13.
→ Đáp án D
Câu 18: Khối lượng của 0,1 mol kim loại kẽm là:
m
Zn = 0,1.65 = 6,5 gam
→ Đáp án C
II. TỰ LUẬN
Câu 1:
a) 4K + O2 → 2K2O
b) 6Na
OH + Fe2(SO4)3 → 2Fe(OH)3↓ + 3Na2SO4
c) Ba
Cl2 + 2Ag
NO3 → 2Ag
Cl↓ + Ba(NO3)2
Câu 2:
a) Phương trình hóa học:
2Mg + O2 →to2Mg
O
b) Áp dụng định hình thức bảo toàn trọng lượng ta có:
m
Mg+m
O2=m
Mg
O→m
O2=m
Mg
O−m
Mg= 30 – 18 = 12 gam
c) Số mol Mg
O là:n
Mg
O=3024+16=0,75 mol
Phương trình hóa học:
Mg
O+2HCl→Mg
Cl2+H2O0,75→1,5 mol
Thể tích dung dịch HCl cần dùng là:
VHCl=1,51=1,5lít
Phòng giáo dục và đào tạo và Đào sản xuất .....
Đề khảo sát chất lượng Học kì 1
Năm học tập 2022 - 2023
Môn: Hóa học tập 8
Thời gian làm bài: 45 phút
Đề thi học kì 1 Hoá học tập lớp 8 năm 2022 - 2023 bao gồm đáp án Đề số 3
(Cho C=12, O=16, H=1, Na=23, K=39, Mg =24, Ca=40, P=31, Cl =35,5, Fe=56, Al =27, N=14, S=32)
I- TRẮC NGHIỆM (7 Điểm)
Câu 1. trong những hiện tượng sau, hiện tượng lạ nào là hiện tượng kỳ lạ hóa học?
A. Sáng sủa sớm, lúc mặt trời mọc sương mù tan dần.
B. Tương đối nước trong số đám mây dừng tụ cùng rơi xuống tạo thành thành mưa.
C. Hòa tan muối vào nước tạo thành thành dung dịch nước muối.
D. Chuối chín
Câu 2. Trong số nhóm cách làm hóa học tập sau, team nào toàn solo chất?
A. CH4, H2SO4, NO2, Ca
CO3.
B. K, N, Na, H2, O2.
C. Cl2, Br2, H2O, Na.
D. CH4, Fe
SO4, Ca
CO3, H3PO4.
Câu 3. Cho thấy thêm Fe (III), SO4 (II), phương pháp hóa học nào viết đúng?
A. Fe
SO4.
B. Fe(SO4)2.
C. Fe2SO4.
D. Fe2(SO4)3.
Câu 4. Phân tử khối của Fe
SO4 là:
A. 152g.
B. 152 đv
C.
C. 152.
D. Cả B cùng C các đúng.
Câu 5. Khi quan ngay cạnh một hiện tượng, dấu hiệu nào cho thấy thêm có phản ứng hóa học xảy ra?
A. Bao gồm chất kết tủa (chất không tan)
B. Bao gồm sự thay đổi màu sắc.
C. Bao gồm chất khí thoát ra (chất cất cánh hơi).
D. Một trong những các dấu hiệu trên.
Câu 6. Tất cả phương trình hóa học: 2H2 + O2 → 2H2O. Theo định phương tiện bảo toàn trọng lượng thì:
A. M
H2+m
O2= m
H2O.
B.m
H2= m
O2+ m
H2O
C. M
O2= m
H2+ m
H2O.
D.m
H2− m
O2= m
H2O.
Câu 7. Phản ứng hóa học là:
A. Vượt trình biến hóa từ hóa học này thành hóa học khác.
B. Hiện tượng lạ chất thay đổi có tạo nên chất khác.
C. Hiện tượng kỳ lạ chất chuyển đổi mà vẫn giữ nguyên là chất ban đầu.
D. Vượt trình biến đổi hình dạng vật thể
Câu 8. mang đến phương trình hóa học:
4Al + 3O2 → 2Al2O3.
Biết cân nặng của Al tham gia phản ứng là 1,35g với lượng Al2O3 thu được là 2,5g. Vậy lượng O2 sẽ tham gia bội phản ứng là bao nhiêu?
A. 1,25g.
B. 1,15g.
C. 1,1g.
D. 3,85g.
Câu 9. Để tính thể tích hóa học khí (đktc) ta vận dụng công thức nào?
A. N = m × M.
B. M = n × M.
C. V = n × 22,4.
D. V = n × 24.
Câu 10. Để tính được cân nặng chất gia nhập hay sản phẩm ta áp dụng công thức nào?
A. M = n × M.
B. M = m : n.
C. M = n : M.
D. M = m : n.
Câu 11. Khí H2 nặng trĩu hay nhẹ hơn không khí bao nhiêu lần?
A. Nặng rộng không khí 0,069 lần.
B. Nhẹ nhàng hơn không khí 0,069 lần.
C. Nặng rộng không khí 14,5 lần.
D. Nhẹ hơn không khí 14,5 lần.
Câu 12. Trong cách làm hóa học: Ca
CO3. Tỉ trọng số mol của các nguyên tố Ca : C : O là:
A. 1: 1: 1.
B. 1: 1: 2.
C. 1: 1: 3.
D. 2: 1: 3.
Câu 13. Quy trình sau đó là hiện tượng vật lí:
A. Nước đá tan thành nước lỏng.
B. Hiđro tính năng với oxi sản xuất nước
C. Đường cháy thành than
D. Củi cháy thành than.
Câu 14. Đốt lưu huỳnh ngoại trừ không khí, sulfur hóa phù hợp với oxi tạo thành khí có mùi hắc là khí sunfurơ. Phương trình chất hóa học đúng để diễn đạt phản ứng trên là:
A. 2S + O2→to SO2
B. 2S + 2O2 →to2SO2
C. S + 2O →to
SO2
D. S + O2 →to
SO2
Câu 15. vào một làm phản ứng hóa học, tồng khối lượng các hóa học ……..bằng tổng khối lượng các chất tạo thành.
Cụm từ còn thiếu trong lốt ở (……) là:
A. Sản phẩm
B. Chế tác thành
C. Tham gia
D. Hóa học
Câu 16. Nên chọn lựa hệ số phù hợp cho phương trình chất hóa học sau:
2Al + 3H2SO4 → Al2(SO4)3 + ?
H2
A. 3
B. 2
C. 1
D. 4
Câu 17. Hóa trị cùa sắt trong cách làm Fe2(SO4)3 là:
A. I
B. II
C. III
D. IV
Câu 18. Công thức hóa học viết không nên là:
A. NO2
B. K2O
C. Mg
Cl
D. H2O
II- TỰ LUẬN (4 điểm)
Câu 1. (1 điểm) Lập công thức hóa học và tính phân tử khối của cách làm vừa lập.
a) sắt (II) và Oxi.
b) Al (III) và nhóm SO4 (II).
Câu 2. Hoàn thành các phương trình hóa học sau: (2 điểm)
a) p + O2 −−−>P2O5
b) Na
OH + H2SO4 −−−>Na2SO4 + H2O
c) Fe(OH)3 −−−> Fe2O3 + H2O
d) Al + Cu
SO4 −−−>Cu + Al2(SO4)3.
Câu 3. (1 điểm)
a) Tính số mol của 1,12 lít khí O2 ở điều kiện tiêu chuẩn?
b) Tính khối lượng của 0,25 mol CO2?
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
I- TRẮC NGHIỆM
1. D | 2. B | 3. D | 4. B | 5. D | 6. A | 7. A | 8. B | 9. C |
10. A | 11. B | 12. C | 13. A | 14. D | 15. C | 16. A | 17. C | 18. C |
Câu 1:
Hiện tượng chất hóa học là hiện tượng lạ chất này thay đổi thành chất mới.
→ Đáp án D
Câu 2: Đơn hóa học là số đông chất chỉ tạo bởi vì 1 yếu tắc hóa học.
→ Đáp án B
Câu 3: Gọi công thức phải tìm là Fex(SO4)y.
Ta có:x.III=y.II→xy=IIIII=23
→ x = 2 cùng y = 3.
→ cách làm là Fe2(SO4)3.
→ Đáp án D
Câu 4:
Phân tử khối của Fe
SO4 là 56 + 32 + 16.4 = 152 đv
C
→ Đáp án B
Câu 5:
Phản ứng hóa học xảy ra khi có sự lộ diện một trong số dấu hiệu sau:
+ gồm chất kết tủa.
+ tất cả chất khí bay ra.
+ bao gồm sự đổi khác màu sắc.
→ Đáp án D
Câu 6: Áp dụng định dụng cụ bảo toàn khối lượng ta có:
m
H2+m
O2= m
H2O
→ Đáp án A
Câu 7: Phản ứng hóa học là quá trình biến đổi chất này thành chất khác.
→ Đáp án A
Câu 8: Áp dụng định phương tiện bảo toàn cân nặng ta có:
m
Al+m
O2=m
Al2O3→m
O2=2,5 – 1,35 = 1,15 gam
→ Đáp án B
Câu 9: Ở điều kiện tiêu chuẩn, thể tích khí tính theo công thức: V = n.22,4 (lít)
→ Đáp án C
Câu 10: Công thức tính khối lượng chất là: m = n. M
Trong đó, n là số mol chất; M là phân tử khối của chất.
→ Đáp án A
Câu 11: Tỉ khối của H2 so với không khí là: d
H2/kk=229=0,0691 .
→ Khí H2 nhẹ hơn không khí 0,069 lần
→ Đáp án B
Câu 12:
Tỉ lệ số mol của những nguyên tố Ca : C : O = 1 : 1 : 3.
→ Đáp án C
Câu 13:
Hiện tượng đồ dùng lý là hiện tượng lạ chất biến hóa nhưng vẫn nguyên hóa học ban đầu.
Thí dụ: chuyển từ tinh thần này thanh lịch trạng thái khác.
→ Đáp án A
Câu 14:
Phương trình hóa học:
S + O2 →to
SO2
→ Đáp án D
Câu 15:
Trong một phản nghịch ứng hóa học, tồng khối lượng các chất tham gia bằng tổng trọng lượng các hóa học tạo thành.
→ Đáp án C
Câu 16:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
→ Đáp án A
Câu 17: Hóa trị cùa fe trong cách làm Fe2(SO4)3 là III.
→ Đáp án C
Câu 18: Công thức hóa học viết sai là Mg
Cl.
Công thức chính xác là Mg
Cl2.
II- TỰ LUẬN
Câu 1:
a) Gọi cách làm hóa học yêu cầu tìm là Fex
Oy.
Theo luật lệ hóa trị, ta có: II.x = II.y→xy=IIII=11
→ x = 1 với y = 1
→ phương pháp là Fe
O.
Phân tử khối của Fe
O là: 56 + 16 = 72 đv
C.
b) Gọi phương pháp hóa học bắt buộc tìm là Alx(SO4)y.
Theo nguyên tắc hóa trị, ta có: III.x = II.y→xy=IIIII=23
→ x = 2 cùng y = 3
→ công thức là Al2(SO4)3.
Phân tử khối của Al2(SO4)3 là: 27.2 + (32 + 16.4).3 = 342 đv
C.
Câu 2:
a) 4P + 5O2 →to2P2O5
b) 2Na
OH + H2SO4 → Na2SO4 + 2H2O
c) 2Fe(OH)3 →to Fe2O3 + 3H2O
d) 2Al + 3Cu
SO4 → 3Cu + Al2(SO4)3.
Câu 3:
a) n
O2=1,1222,4=0,05 mol
b) m
CO2=0,25.44=11 gam
Phòng giáo dục đào tạo và Đào chế tạo .....
Đề khảo sát chất lượng Học kì 1
Năm học tập 2022 - 2023
Môn: Hóa học tập 8
Thời gian làm bài: 45 phút
Đề thi học tập kì 1 Hoá học lớp 8 năm 2022 - 2023 gồm đáp án Đề số 4
(Cho C=12, O=16, H=1, Na=23, K=39, Mg =24, Ca=40, P=31, Cl =35,5, Fe=56, Al=27, N=14, S=32)
Câu 1: khối lượng của 1 nguyên tử cacbon là:
A. 1,9926.10-23g
B. 1,9926g
C. 1,9926.10-23đv
C
D. 1,9926đv
C.
Câu 2: hiện tượng lạ hoá học khác với hiện tượng vật lý là:
A. Chuyển đổi về hình dạng.
B. Bao gồm sinh ra chất mới.
C. Chỉ thay đổi về trạng thái.
D. Cân nặng thay đổi.
Câu 3: trong 1 phản ứng hoá học, các chất bội nghịch ứng và thành phầm có cùng:
A. Số nguyên tố tạo nên chất.
B. Số phân tử của từng chất.
C. Số nguyên tử của từng nguyên tố.
D. Số phân tử trong những chất.
Câu 4: Trong quá trình phản ứng, lượng chất phản ứng:
A. Sút dần
B. Giữ nguyên.
C. Tăng
D. Cả A, B, C.
Câu 5: Số electron lớp bên ngoài cùng của nguyên tử Al (có số proton =13) là:
A. 1
B. 2
C. 3
D. 4.
Câu 6: Số lớp electron của nguyên tử Al (có số proton =13) là:
A. 1
B. 2
C. 3
D. 4.
Câu 7: Số e trong nguyên tử Al (có số proton =13) là:
A. 10
B. 11
C. 12
D. 13.
Câu 8: tỉ lệ thành phần % trọng lượng của những nguyên tố Ca, C, O vào Ca
CO3 lần lượt là:
A. 40%; 40%; 20%
B. 40%; 12%; 48%
C. 10% ; 80% ; 10%
D. 20% ; 40% ; 40%
Câu 9: cân nặng của 1 đv
C là:
A. 1,6605.10-24g
B. 6.1023g
C. 1,6605.10-23g
D. 1,9926.10-23g
Câu 10: trong hợp hóa học Ax
By . Hoá trị của A là m, hoá trị của B là n thì nguyên tắc hóa trị là:
A. M.A= n.B
B. M.x = n.y
C. M.n = x.y
D. M.y = n.x
Câu 11: Cho sơ vật phản ứng: Fe(OH)y + H2SO4 → Fex(SO4)y + H2O. Biết sắt trong các hợp hóa học trên tất cả hóa trị III thì hệ số của những chất trong làm phản ứng thứu tự là:
A. 1: 3:1:6
B. 2:3:1:6
C. 2:6:1:6
D. 1:6:2:6
Câu 12: Dãy nguyên tố sắt kẽm kim loại là:
A. K, Na, Mn, Al, Ca.
C. Na, Mg, C, Ca, Na.
B. Ca, S, Cl, Al, Na.
D. Al, Na, O, H, S.
Câu 13: Công thức chuyển đổi giữa lượng hóa học và khối lượng là:
A. M = n.M
B. M = n
M.
C. M = n.m.
D. M.m = n
Câu 14: Cho 5,6g fe Fe tác dụng với hỗn hợp axit clohiđric HCl tạo ra 12,7g fe (II) clorua Fe
Cl2và 0,2g khí H2. Cân nặng HCl đã sử dụng là:
A. 7,3g
B. 14,2g
C. 9,2g
D. 8,4g
Câu 15: Chất ở trong hợp chất hóa học là:
A. O2.
B. N2.
C. H2.
D. CO2.
Câu 16: Khí SO2 nặng rộng khí O2 bao nhiêu lần?
A. 1,5 lần.
B. 1,7 lần.
C. 2 lần.
D. 1,2 lần
Câu 17: Trong những vật sau, đâu là đồ vật thể từ nhiên?
A. đơn vị ở.
B. Quần áo.
C. Cây cỏ.
D. Đồ dùng học tập.
Xem thêm: Cách tìm unikey trên máy tính
Câu 18: Nguyên tử N bao gồm hoá trị III vào phân tử hóa học nào sau đây?
A. N2O5
B. NO
C. N2O3.
D. NO2
Câu 19: Khối lượng của 0,5 mol CO2 là:
A. 22g
B. 28g
C. 11,2g
D. 44g
Câu 20: Đốt cháy quặng pirit fe (Fe
S2) thu được sắt(III) oxit Fe2O3 và khí sunfurơ SO2. Phương trình phản bội ứng nào tiếp sau đây đã viết đúng?
A.4Fe
S2 + 11O2 →to2Fe2O3 + 8SO2
B.2Fe
S2 + O2 →to
Fe2O3 + SO2
C.4Fe
S2 + 11O2 →to
Fe2O3 + 8SO2
D.Fe
S2 + O2 →to
Fe2O3 + 2SO2
Câu 21: Số phân tử có trong một mol O2 là:
A.6,02.1023
B.12,04.1023
C.6,04.1023
D.18,06.1